Perbedaan antara faktor pengenceran dan pengenceran

Perbedaan utama - faktor pengenceran vs pengenceran
Faktor pengenceran dan pengenceran adalah istilah umum yang digunakan untuk perhitungan dalam kimia analitik. Pengenceran mengacu pada penurunan konsentrasi zat terlarut tertentu dalam suatu larutan. Istilah ini dapat digunakan untuk menggambarkan cairan dan gas. Faktor pengenceran adalah ukuran pengenceran; itu menggambarkan tingkat pengenceran. Perbedaan utama antara faktor pengenceran dan pengenceran adalah bahwa Pengenceran larutan adalah penurunan konsentrasi zat terlarut dalam larutan itu sedangkan faktor pengenceran adalah rasio antara volume akhir dan volume awal larutan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu pengenceran
3. Apa faktor pengenceran
4. Perbandingan berdampingan -faktor pengenceran vs pengenceran dalam bentuk tabel
5. Ringkasan
Apa itu pengenceran?
Pengenceran larutan adalah penurunan konsentrasi zat terlarut dalam larutan itu. Solusi terdiri dari pelarut yang telah melarutkan zat terlarut di dalamnya. Konsentrasi zat terlarut ini diberikan sebagai molaritas atau molalitas. Molaritas adalah jumlah zat terlarut yang ada dalam satuan volume larutan (diberikan oleh unit mol/L). Molalitas adalah massa zat terlarut yang ada dalam volume satuan (diberikan oleh unit kg/L). Ketika konsentrasi zat terlarut dalam larutan ini berkurang, itu disebut larutan encer.
Pengenceran dilakukan dengan hanya menambahkan lebih banyak pelarut ke solusi, menahan konten zat terlarut konstan. Misalnya, larutan berair yang mengandung natrium klorida (NaCl) dapat diencerkan dengan menambahkan lebih banyak air. Jika zat terlarut adalah senyawa berwarna, warna larutan memudar saat larutan menjadi diencerkan.

Gambar 1: Warna pudar saat diencerkan
Perhitungan konsentrasi akhir
Konsentrasi akhir larutan dapat ditentukan dengan menggunakan hubungan berikut.
C1V1 = C2V2
C1 adalah konsentrasi awal
V1 adalah volume awal
C2 adalah konsentrasi akhir
V2 adalah volume akhir dari solusi.
Contoh: Larutan air KCL berisi 2.0 mol kcl dalam 0.2 l air. Apa yang akan menjadi konsentrasi akhir dari larutan KCL jika air (400 mL) ditambahkan?
Konsentrasi awal kcl (C1) = 2.0 mol/0.2l = 10 mol/l
Volume awal solusi (v1) = 0.2 l
Volume akhir dari solusi (v2) = 0.2 L + 0.4 l = 0.6 l
Konsentrasi akhir larutan (C2) dapat ditentukan menggunakan:
C1V1 = C2V2
10 mol/l x 0.2 l = c2 x 0.6 l
C2 = 2 mol / 0.6 l = 3.33 mol/l
Apa faktor pengenceran?
Faktor pengenceran (juga dikenal sebagai rasio pengenceran) adalah rasio antara volume akhir dan volume awal solusi. Volume akhir adalah volume larutan setelah pengenceran. Volume awal adalah volume larutan sebelum encer, atau volume larutan asli yang digunakan untuk pengenceran. Hubungan ini juga dapat digunakan bersama dengan massa zat terlarut.
Perhitungan faktor pengenceran
Faktor pengenceran = volume akhir (v2) / volume awal (v1)
Contoh: pengenceran 200 ml kmno4 Solusi berair dengan menambahkan 200ml air,
Faktor pengenceran = (200ml + 200ml) / 200ml
= 400 ml /200ml
= 2
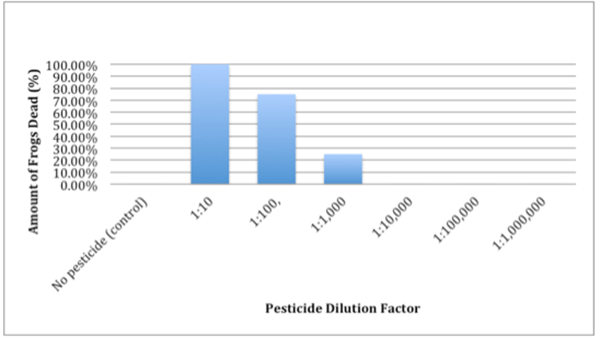
Gambar 02: Grafik Faktor Pengenceran
Diagram di atas menunjukkan grafik dari penelitian di mana kematian katak dihitung bersama dengan pengenceran pestisida yang ditambahkan ke ekosistem.
Apa perbedaan antara faktor pengenceran dan pengenceran?
Faktor pengenceran vs pengenceran | |
| Pengenceran larutan adalah penurunan konsentrasi zat terlarut dalam larutan itu. | Faktor pengenceran (rasio pengenceran) adalah rasio antara volume akhir dan volume awal larutan. |
| Konsep | |
| Pengenceran adalah penurunan konsentrasi. | Faktor pengenceran adalah ukuran pengenceran. |
| Tekad | |
| Pengenceran ditentukan oleh persamaan C1V1 = C2V2. | Faktor pengenceran ditentukan dengan membagi volume akhir larutan dari volume awal. |
| Satuan | |
| Pengenceran memberikan konsentrasi akhir dalam unit mol/L. | Faktor pengenceran adalah Unitless. |
Ringkasan -Faktor Pengenceran vs Pengenceran
Faktor pengenceran dan pengenceran adalah istilah yang sangat umum dalam kimia. Faktor pengenceran adalah ukuran pengenceran. Perbedaan utama antara faktor pengenceran dan pengenceran adalah bahwa pengenceran larutan adalah penurunan konsentrasi zat terlarut dalam larutan tersebut sedangkan faktor pengenceran adalah rasio antara volume akhir dan volume awal larutan.
Referensi:
1. “Pengenceran (Persamaan).”Wikipedia, Wikimedia Foundation, 12 Feb. 2018, tersedia di sini.
2. “Pengenceran: Penjelasan dan Contoh.Quansys Biosciences, tersedia di sini.
Gambar milik:
1. "Dilusi Difusi" oleh Tess Watson (CC oleh 2.0) Via Flickr
2. "Gambar 1 Xenopus Laevis" oleh Krmeyer0717 - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


