Perbedaan antara EDTA dan EGTA
EDTA vs EGTA
EDTA dan EGTA keduanya adalah agen chelating. Keduanya adalah asam poliamino karboksilat dan memiliki sifat yang lebih atau kurang sama.
EDTA
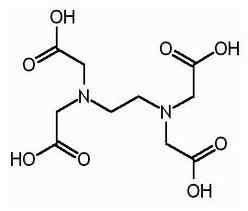
EDTA adalah nama yang dipersingkat untuk asam tetraasetat etilena diamine. Ini juga dikenal sebagai asam tetraasetat (ethylene dinitrilo). Berikut ini adalah struktur EDTA.

Molekul EDTA memiliki enam situs di mana ion logam dapat diikat. Ada dua kelompok amino dan empat kelompok karboksil. Dua atom nitrogen dari kelompok amino memiliki pasangan elektron yang tidak dibagi di masing -masing. EDTA adalah ligan heksadentat. Juga, ini adalah agen pengkelat karena kemampuan untuk menyita ion logam. EDTA membentuk chelate dengan semua kation kecuali logam alkali dan chelate ini cukup stabil. Stabilitas hasil dari beberapa situs pengompleksan dalam molekul yang menimbulkan kandang seperti struktur yang mengelilingi ion logam. Ini mengisolasi ion logam dari molekul pelarut, sehingga mencegah solvasi. Kelompok karboksil EDTA dapat memisahkan proton yang menyumbang; Oleh karena itu, EDTA memiliki sifat asam. Berbagai spesies EDTA disingkat h4Y, h3Y-, H2Y2-, Hy3- dan y4-. Pada pH yang sangat rendah (medium asam), bentuk EDTA terprotonasi (h4Y) dominan. Sebaliknya, pada pH tinggi (media dasar), bentuk yang sepenuhnya terdeprotonasi (y4-) mendominasi. Dan karena pH berubah dari pH rendah ke pH tinggi, bentuk EDTA lainnya mendominasi dalam nilai pH tertentu. EDTA tersedia sebagai bentuk yang sepenuhnya terprotonasi atau bentuk garam. Disodium EDTA dan Kalsium Disodium EDTA adalah bentuk garam yang paling umum tersedia. Asam bebas h4Y dan dihidrat dari garam natrium na2H2Y.2h2O tersedia secara komersial dalam kualitas reagen.
Saat larut dalam air, EDTA bertindak seperti asam amino. Itu ada sebagai zwitterion ganda. Dalam kesempatan ini, muatan bersih adalah nol, dan ada empat proton yang dapat dipisahkan (dua proton dikaitkan dengan gugus karboksil dan dua yang terkait dengan gugus amina). EDTA banyak digunakan sebagai titran kompleksometri. Solusi EDTA penting sebagai titran karena digabungkan dengan ion logam dalam rasio 1: 1 terlepas dari muatan pada kation. EDTA juga digunakan sebagai pengawet untuk sampel biologis. Sejumlah kecil ion logam yang ada dalam sampel biologis, dan makanan dapat mengkatalisasi oksidasi udara senyawa yang ada dalam sampel. EDTA sangat kompleks ion logam ini, sehingga mencegahnya dari oksidasi udara. Itulah mengapa dapat digunakan sebagai pengawet.
EGTA
EGTA adalah istilah yang disingkat untuk asam etilena glikol tetraasetat.Ini adalah agen pengkelat, dan sangat mirip dengan EDTA. EGTA memiliki afinitas yang lebih tinggi untuk ion kalsium daripada ion magnesium. EGTA memiliki struktur berikut.
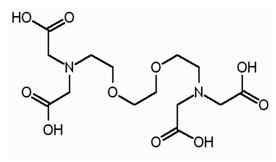
Mirip dengan EDTA, EGTA juga memiliki empat gugus karboksil, yang dapat menghasilkan empat proton setelah disosiasi. Ada dua kelompok amina dan dua atom nitrogen dari kelompok amino memiliki pasangan elektron yang tidak dibagi di masing -masing. EGTA dapat digunakan sebagai buffer menyerupai pH sel hidup. Properti EGTA ini memungkinkan penggunaannya dalam pemurnian afinitas tandem, yang merupakan teknik pemurnian protein.
| Apa perbedaan antara EDTA dan EGTA? • EDTA adalah asam tetraasetat etilen diamine dan EGTA adalah asam etilen glikol tetraasetat. • EGTA memiliki berat molekul lebih tinggi dari EDTA. • Selain empat gugus karboksil, dua gugus amino, EGTA juga memiliki dua atom oksigen lainnya dengan elektron yang tidak dibagi. • EGTA memiliki afinitas yang lebih tinggi dengan ion kalsium dibandingkan dengan EDTA. Dan EDTA memiliki afinitas yang lebih tinggi terhadap ion magnesium dibandingkan dengan EGTA. • EGTA memiliki titik didih yang lebih tinggi dari EDTA. |


