Perbedaan antara elektronegativitas dan polaritas
Itu perbedaan utama antara elektronegativitas dan polaritas adalah itu elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas berarti pemisahan muatan.
Polaritas muncul karena perbedaan elektronegativitas. Oleh karena itu, kedua istilah ini terkait erat. Namun, ada perbedaan yang berbeda antara elektronegativitas dan polaritas. Salah satu perbedaan antara elektronegativitas dan polaritas adalah bahwa elektronegativitas menggambarkan gaya tarik pada tingkat atom sementara polaritas menggambarkan gaya tarik pada tingkat molekuler.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektronegativitas
3. Apa itu polaritas
4. Perbandingan berdampingan - elektronegativitas vs polaritas dalam bentuk tabel
5. Ringkasan
Apa itu elektronegativitas?
Elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya. Pada dasarnya, ini menunjukkan "rupa" atom terhadap elektron. Kita dapat menggunakan skala Pauling untuk menunjukkan elektronegativitas elemen.
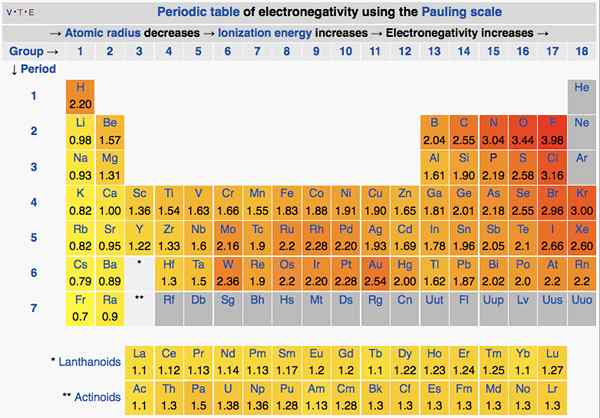
Dalam tabel periodik, elektronegativitas berubah sesuai dengan suatu pola. Dari kiri ke kanan, pada suatu periode, elektronegativitas meningkat. Dari atas ke bawah, pada kelompok, elektronegativitas berkurang. Oleh karena itu, fluor adalah elemen paling elektronegatif dengan nilai 4.0 pada skala Pauling. Grup Satu dan Dua Elemen memiliki lebih sedikit elektronegativitas; Dengan demikian, mereka cenderung membentuk ion positif dengan memberikan elektron. Karena kelompok 5, 6, 7 elemen memiliki nilai elektronegativitas yang lebih tinggi, mereka suka mengambil elektron dalam dan dari ion negatif.

Gambar 01: Elektronegativitas elemen dalam tabel periodik
Elektronegativitas juga penting dalam menentukan sifat ikatan. Jika dua atom dalam ikatan tidak memiliki perbedaan elektronegativitas, maka ikatan kovalen akan terbentuk. Jika perbedaan elektronegativitas antara keduanya tinggi, maka ikatan ionik akan terbentuk.
Apa itu polaritas?
Muncul polaritas karena perbedaan elektronegativitas atom. Ketika dua atom atau atom yang sama memiliki elektronegativitas yang sama membentuk ikatan di antara mereka, atom -atom ini menarik pasangan elektron dengan cara yang sama. Oleh karena itu, mereka cenderung berbagi elektron, dan ikatan nonpolar semacam ini dikenal sebagai ikatan kovalen. Namun, ketika kedua atom berbeda, elektronegativitasnya seringkali berbeda. Tetapi tingkat perbedaan mungkin lebih tinggi atau lebih rendah. Oleh karena itu, pasangan elektron terikat ditarik lebih banyak dengan satu atom dibandingkan dengan atom lainnya yang berpartisipasi dalam membuat ikatan. Dengan demikian, itu akan menghasilkan distribusi elektron yang tidak setara antara kedua atom. Selain itu, jenis ikatan kovalen ini dikenal sebagai ikatan kutub.
Karena berbagi elektron yang tidak merata, satu atom akan memiliki muatan yang sedikit negatif, sedangkan atom lainnya akan memiliki muatan yang sedikit positif. Pada saat ini, kami mengatakan bahwa atom telah memperoleh muatan positif negatif atau parsial parsial. Atom dengan elektronegativitas yang lebih tinggi mendapatkan muatan negatif parsial, dan atom dengan elektronegativitas yang lebih rendah akan mendapatkan muatan positif parsial. Polaritas mengacu pada pemisahan tuduhan. Molekul -molekul ini memiliki momen dipol.
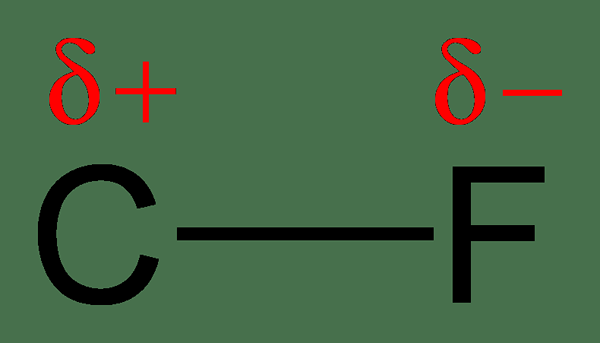
Gambar 2: Pemisahan muatan dalam ikatan C-F; Fluor lebih elektronegatif daripada karbon
Dalam molekul, setidaknya ada satu ikatan atau lebih. Beberapa ikatan bersifat polar sementara beberapa non-polar. Agar molekul menjadi kutub, semua ikatan harus secara kolektif menghasilkan distribusi muatan yang tidak rata dalam molekul.
Molekul kutub
Selain itu, molekul memiliki geometri yang berbeda, sehingga distribusi ikatan juga menentukan polaritas molekul. Misalnya, hidrogen klorida adalah molekul polar dengan hanya satu ikatan. Molekul air adalah molekul polar dengan dua ikatan. Momen dipol dalam molekul -molekul ini bersifat permanen karena telah muncul karena perbedaan elektronegativitas. Tapi, ada molekul lain yang hanya bisa polar pada kesempatan tertentu. Molekul dengan dipol permanen dapat menginduksi dipol dalam molekul non-polar lain, maka yang juga akan menjadi molekul kutub sementara. Bahkan dalam suatu molekul, perubahan tertentu dapat menyebabkan momen dipol sementara.
Apa perbedaan antara elektronegativitas dan polaritas?
Elektronegativitas adalah ukuran kecenderungan atom untuk menarik sepasang elektron ikatan sementara polaritas adalah sifat memiliki kutub atau menjadi kutub. Jadi, perbedaan utama antara elektronegativitas dan polaritas adalah bahwa elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas adalah pemisahan muatan.
Selain itu, perbedaan tambahan antara elektronegativitas dan polaritas adalah bahwa elektronegativitas menggambarkan gaya tarik pada tingkat atom sementara polaritas menggambarkan gaya tarik pada tingkat molekuler. Oleh karena itu, daya tarik antara nukleus atom dan elektron terluar adalah alasan atom memiliki nilai elektronegativitas; dengan demikian, ia menentukan nilai elektronegativitas. Tapi, polaritas disebabkan oleh pemisahan muatan dalam ikatan karena perbedaan nilai elektronegativitas atom.
Infografis di bawah ini menunjukkan lebih banyak detail tentang perbedaan antara elektronegativitas dan polaritas.
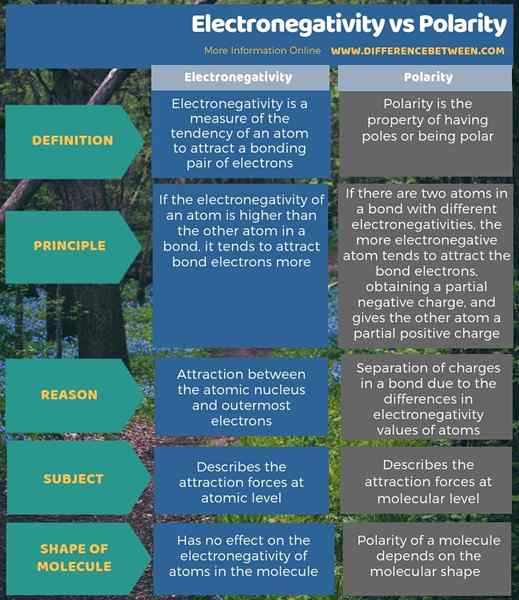
Ringkasan -Elektronegativitas vs Polaritas
Elektronegativitas dan polaritas adalah istilah terkait; Elektronegativitas atom dalam molekul menentukan polaritas molekul. Perbedaan utama antara elektronegativitas dan polaritas adalah bahwa elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas berarti pemisahan muatan.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh elektronegativitas."Thoughtco, OCT. 17, 2018, tersedia di sini.
Gambar milik:
1. “Tabel Berkala Pauling Electronegatvity” oleh DMacks - (CC BY -SA 3.0) Via Commons Wikimedia
2. “Karbon-Fluorin-Bond-Polarity-2D” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


