Perbedaan antara elektrovalensi dan kovalensi
Itu perbedaan utama Antara elektrovalensi dan kovalensi adalah bahwa Elektrovalensi adalah jumlah elektron yang diperoleh atau kerugian dalam membentuk ion sedangkan kovalensi adalah jumlah elektron yang dapat dibagikan oleh atom dengan atom lain.
Meskipun istilah elektrovalensi dan kovalensi terdengar serupa, mereka berbeda satu sama lain sesuai dengan definisi mereka. Terutama, elektrovalensi menjelaskan pembentukan ion sedangkan kovalensi menjelaskan pembentukan ikatan kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektrovalensi
3. Apa itu kovalensi
4. Perbandingan berdampingan - elektrovalensi vs kovalensi dalam bentuk tabel
5. Ringkasan
Apa itu elektrovalensi?
Elektrovalensi adalah jumlah elektron yang diperoleh atau hilang selama pembentukan ion dari atom itu. Oleh karena itu, ini mengacu pada jumlah elektron yang diperoleh atom atau kerugian saat membentuk ikatan elektrovalen, kami menyebutnya ikatan ionik. Menurut penjelasan ini, ini memberikan muatan listrik bersih pada ion. Selain itu, jika atom kehilangan elektron saat membentuk ikatan ionik menunjukkan elektrovalensi positif saat jika sebuah atom mendapatkan elektron saat membentuk ikatan ionik, itu menunjukkan bahwa atom memiliki elektrovalensi negatif. Senyawa dengan atom yang memiliki elektrovalensi adalah senyawa ionik.

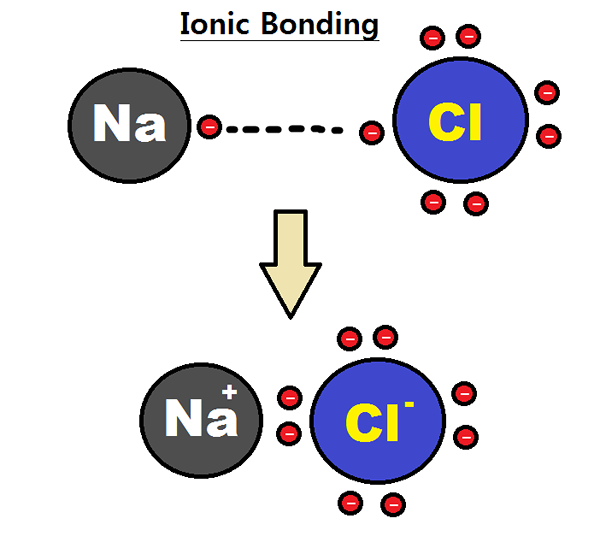
Gambar 01: Pembentukan ikatan ionik
Misalnya, mari kita pertimbangkan pembentukan natrium klorida (NaCl). Di sana, atom natrium kehilangan satu elektron; Dengan demikian ia memiliki elektrovalensi yang positif. Atom klorin memperoleh elektron itu. Dengan demikian, ia memiliki elektrovalensi negatif. Namun, karena jumlah elektron yang hilang atau diperoleh adalah satu, elektrovalensi natrium (atau klorin) adalah satu. Kita harus memberikan elektrovalensi dengan desahan yang sesuai untuk menunjukkan apakah itu elektrovalensi positif atau negatif.
- Natrium = natrium elektrovalensi positif dapat diberikan sebagai +1.
- Klorin = elektrovalensi negatif klorin dapat diberikan sebagai -1.
Apa itu kovalensi?
Kovalensi adalah jumlah maksimum elektron yang dapat dibagikan dengan atom lain. Oleh karena itu, ini menunjukkan jumlah maksimum ikatan kovalen yang dapat dibentuk oleh atom menggunakan orbital kosongnya. Nilai parameter ini tergantung pada jumlah elektron valensi dari atom dan jumlah orbital kosong yang ada dalam atom.
Misalnya, atom hidrogen hanya memiliki satu elektron; Dengan demikian, ia dapat berbagi satu elektron dengan atom lain. Oleh karena itu, kovalensi hidrogen adalah 1. Tidak seperti di elektrovalensi, kami tidak perlu tanda plus atau minus karena tidak ada kerugian atau gain elektron; Hanya elektron yang dibagikan satu sama lain.
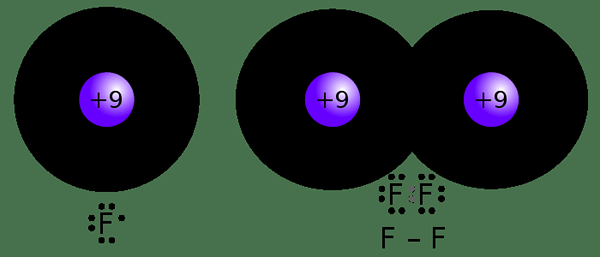
Gambar 02: Pembentukan ikatan kovalen
Seperti yang kami sebutkan di atas, tidak hanya jumlah elektron valensi tetapi juga jumlah orbital kosong atom penting dalam menentukan kovalensi. Misalnya, jika kita menganggap karbon sebagai contoh, ia memiliki 4 elektron di cangkang elektron terluar. Di sana, ia memiliki 2s22p2 konfigurasi elektron. Oleh karena itu, ada orbital 2p kosong. Oleh karena itu, dua elektron berpasangan dalam orbital 2S dapat terpisah, dan satu elektron termasuk dalam orbital 2p kosong. Lalu ada 4 elektron yang tidak berpasangan. Karbon dapat berbagi keempat elektron dengan atom lain. Oleh karena itu, kovalensi menjadi 4. Ini karena ketika kami menulis konfigurasi elektron karbon, kami melihat hanya ada 2 elektron yang tidak berpasangan, jadi kami pikir kovalensi karbon adalah 2 ketika sebenarnya 4.
Apa perbedaan antara elektrovalensi dan kovalensi?
Elektrovalensi adalah jumlah elektron yang diperoleh atau hilang selama pembentukan ion dari atom itu. Itu menjelaskan pembentukan ikatan ionik. Selain itu, senyawa yang memiliki atom dengan parameter ini adalah senyawa ionik. Kovalensi, di sisi lain, adalah jumlah elektron maksimum yang dapat dibagikan dengan atom lain. Itu menjelaskan pembentukan ikatan kovalen. Selain itu, senyawa yang memiliki atom dengan kovalensi adalah senyawa kovalen.
Infografis di bawah ini menyajikan perbedaan antara elektrovalensi dan kovalensi dalam bentuk tabel.

Ringkasan -Elektrovalensi vs Kovalensi
Meskipun istilah elektrovalensi dan kovalensi terdengar serupa, mereka memiliki definisi dan karakteristik yang berbeda. Perbedaan antara elektrovalensi dan kovalensi adalah bahwa elektrovalensi adalah jumlah elektron yang diperoleh atom atau kerugian dalam membentuk ion sedangkan kovalensi adalah jumlah elektron yang dapat dibagikan atom dengan atom lain.
Referensi:
1. “2. Ide dasar ikatan.Peran pH dalam kimia kehidupan sehari -hari. Tersedia disini
2. “Struktur kimia-kovalen dan molekul.”Penelitian waktu respons sistem biologi-nervous. Tersedia disini
Gambar milik:
1."Ionicbondingrh11" oleh Rhannosh - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia
2."Covalent Bond Fluorine" oleh Jacek FH - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


