Perbedaan antara entalpi dan entropi
Itu perbedaan utama antara entalpi dan entropi adalah itu Enthalpy adalah perpindahan panas yang terjadi dalam tekanan konstan sedangkan entropi memberikan gambaran tentang keacakan suatu sistem.
Untuk tujuan studi dalam kimia, kami membagi alam semesta menjadi dua sebagai sistem dan sekitarnya. Kapan saja, bagian yang akan kita pelajari adalah sistemnya, dan sisanya ada di sekitarnya. Enthalpy dan Entropy adalah dua istilah yang menggambarkan reaksi yang terjadi dalam suatu sistem dan di sekitarnya. Baik entalpi dan entropi adalah fungsi keadaan termodinamika.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa entalpi
3. Apa itu entropi
4. Perbandingan berdampingan - Entropi entalpi vs dalam bentuk tabel
5. Ringkasan
Apa entalpi?
Ketika suatu reaksi terjadi, itu dapat menyerap atau mengembangkan panas, dan jika kita melakukan reaksi pada tekanan konstan, kita menyebutnya entalpi reaksi. Namun, kami tidak dapat mengukur entalpi molekul. Oleh karena itu, kita perlu mengukur perubahan entalpi selama reaksi. Kita bisa mendapatkan perubahan entalpi (∆H) untuk reaksi dalam suhu dan tekanan yang diberikan dengan mengurangi entalpi reaktan dari entalpi produk. Jika nilai ini negatif, maka reaksinya eksotermik. Jika nilainya positif, maka reaksinya adalah endotermik.

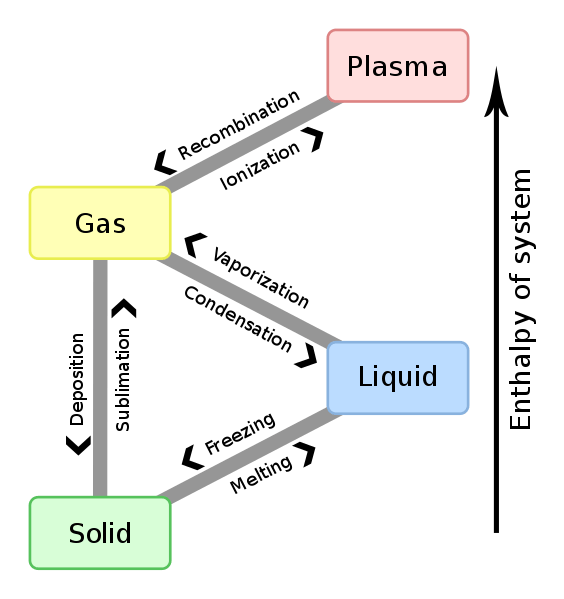
Gambar 01: Hubungan antara perubahan entalpi dan perubahan fase
Perubahan entalpi antara setiap reaktan dan produk tidak tergantung pada jalur di antara mereka. Selain itu, perubahan entalpi tergantung pada fase reaktan. Misalnya, ketika gas oksigen dan hidrogen bereaksi untuk menghasilkan uap air, perubahan entalpi adalah -483.7 kJ. Namun, ketika reaktan yang sama bereaksi untuk menghasilkan air cair, perubahan entalpi adalah -571.5 kJ.
2h2 (g) +o2 (g) → 2h2O (g); ∆H = -483.7 kJ
2h2 (g) +o2 (g) → 2h2O (l); ∆H = -571.7 kJ
Apa itu entropi?
Beberapa hal terjadi secara spontan, yang lain tidak. Misalnya, panas akan mengalir dari tubuh yang panas ke yang lebih dingin, tetapi kita tidak dapat mengamati yang sebaliknya meskipun tidak melanggar konservasi aturan energi. Ketika perubahan terjadi, total energi tetap konstan tetapi dibagi secara berbeda. Kita dapat menentukan arah perubahan dengan distribusi energi. Perubahan spontan jika mengarah pada keacakan dan kekacauan yang lebih besar di alam semesta secara keseluruhan. Kita dapat mengukur tingkat kekacauan, keacakan, atau penyebaran energi dengan fungsi negara; Kami menyebutkannya sebagai entropi.
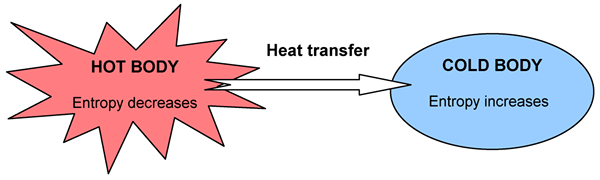
Gambar 02: Diagram yang menunjukkan perubahan entropi dengan perpindahan panas
Hukum kedua termodinamika terkait dengan entropi, dan dikatakan, “Entropi alam semesta meningkat dalam proses spontan."Entropi dan jumlah panas yang dihasilkan saling berhubungan sejauh sistemnya menggunakan energi. Faktanya, jumlah perubahan entropi atau gangguan tambahan yang disebabkan oleh jumlah panas Q tergantung pada suhu. Jika sudah sangat panas, sedikit panas ekstra tidak membuat lebih banyak gangguan, tetapi jika suhunya sangat rendah, jumlah panas yang sama akan menyebabkan peningkatan dramatis dalam gangguan. Oleh karena itu, kita dapat menulisnya sebagai berikut: (di mana DS diubah dalam entropi, DQ diubah dalam panas dan t adalah suhu.
ds = dq/t
Apa perbedaan antara entalpi dan entropi?
Enthalpy dan Entropy adalah dua istilah terkait dalam termodinamika. Perbedaan utama antara entalpi dan entropi adalah bahwa entalpi adalah perpindahan panas terjadi dalam tekanan konstan sedangkan entropi memberikan gambaran tentang keacakan suatu sistem. Selain itu, entalpi berkaitan dengan hukum termodinamika pertama saat entropi berkaitan dengan hukum kedua termodinamika. Perbedaan penting lainnya antara entalpi dan entropi adalah bahwa kita dapat menggunakan entalpi untuk mengukur perubahan energi sistem setelah reaksi sedangkan kita dapat menggunakan entropi untuk mengukur tingkat gangguan sistem setelah reaksi.
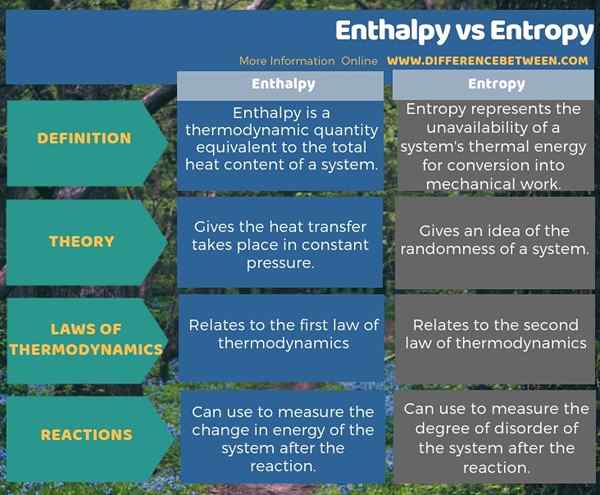
Ringkasan -Entalpi vs Entropi
Enthalpy dan Entropy adalah istilah termodinamika yang sering kita gunakan dengan reaksi kimia. Perbedaan utama antara entalpi dan entropi adalah bahwa entalpi adalah perpindahan panas terjadi dalam tekanan konstan sedangkan entropi memberikan gambaran tentang keacakan suatu sistem.
Referensi:
1. Libretexts. “Enthalpy."Kimia Libretexts, National Science Foundation, 26 Nov. 2018. Tersedia disini
2. Drake, Gordon W.F. “Entropi.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 Juni 2018. Tersedia disini
Gambar milik:
1."Perubahan fase - en” oleh f l a n k e r, penubag - pekerjaan sendiri, (domain publik) via commons wikimedia
2."Entropy Hot to Cold" oleh Ibrahim Dincer dan Yunus A. Cengel - Entropy 2001, 3 (3), 116-149; doi: 10.3390/E3030116 http: // www.mdpi.com/1099-4300/3/3/116, (CC oleh 3.0) Via Commons Wikimedia


