Perbedaan antara keseimbangan dan kondisi mapan
Itu perbedaan utama antara keseimbangan dan kondisi mapan adalah itu Dalam keseimbangan, konsentrasi semua komponen dipegang konstan sedangkan, dalam kondisi mapan, hanya beberapa komponen yang tetap konstan.
Ketika satu atau lebih reaktan dikonversi menjadi produk, mereka dapat melalui berbagai modifikasi dan perubahan energi. Ikatan kimia dalam reaktan rusak, dan ikatan baru dibentuk untuk menghasilkan produk yang sama sekali berbeda dari reaktan. Inilah yang kami sebut reaksi kimia. Keseimbangan dan kondisi mapan adalah konsep kimia penting mengenai berbagai reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu keseimbangan
3. Apa itu Steady State
4. Perbandingan berdampingan - keseimbangan vs kondisi mapan dalam bentuk tabel
5. Ringkasan
Apa itu keseimbangan?
Beberapa reaksi dapat dibalik, sementara beberapa reaksi tidak dapat diubah. Dalam suatu reaksi, reaktan dikonversi menjadi produk. Dalam beberapa reaksi, reaktan menghasilkan lagi dari produk. Kami menyebutkan jenis reaksi ini sebagai reversibel. Dalam reaksi yang tidak dapat diubah, setelah reaktan dikonversi menjadi produk, mereka tidak beregenerasi lagi dari produk.
Dalam reaksi reversibel, ketika reaktan diubah menjadi produk, kami menyebutnya reaksi maju. Saat produk diubah menjadi reaktan, kami menyebutnya sebagai reaksi terbelakang. Ketika laju reaksi maju dan mundur sama, maka reaksi berada pada keseimbangan. Oleh karena itu, jumlah reaktan dan produk tidak berubah selama periode waktu tertentu.

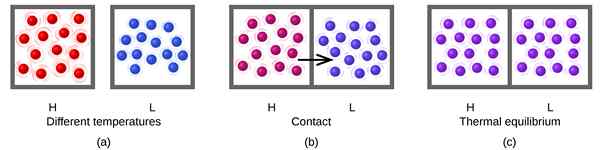
Gambar 01: Keseimbangan termal
Reaksi reversibel selalu cenderung mencapai keseimbangan dan mempertahankan keseimbangan itu. Saat sistem berada pada keseimbangan, jumlah produk dan reaktan tidak harus sama. Mungkin ada jumlah reaktan yang lebih tinggi daripada produk atau sebaliknya. Satu -satunya persyaratan dalam persamaan keseimbangan adalah mempertahankan jumlah konstan dari keduanya seiring waktu. Untuk reaksi dalam keseimbangan, kita dapat mendefinisikan konstanta kesetimbangan, yang sama dengan rasio antara konsentrasi produk dan konsentrasi reaksi.
Apa itu Steady State?
Pertimbangkan reaksi di mana reaktan A pergi ke produk C melalui B Intermediate B. Dalam reaksi seperti ini, B dibentuk oleh A, dan kemudian mengalami penipisan untuk membentuk C. Sebelum reaksi dimulai, hanya ada A, dan B perlahan mulai menumpuk. Namun, seiring waktu, jumlah A berkurang, dan C meningkat, tetapi jumlah B tetap kira -kira sama dari waktu ke waktu. Dalam keadaan ini, segera setelah lebih banyak bentuk B, itu akan menghabiskan untuk memberikan C dengan kecepatan yang cepat mempertahankan konsentrasi keadaan tunak. Dengan demikian, laju sintesis b = tingkat konsumsi b.
A ⟶ B ⟶ C
Asumsi keadaan tunak: D (b)/dt = 0.
Apa perbedaan antara keseimbangan dan kondisi mapan?
Keseimbangan dan kondisi mapan adalah konsep kimia yang penting. Perbedaan utama antara keseimbangan dan kondisi tunak adalah bahwa dalam keseimbangan, konsentrasi semua komponen tetap konstan sedangkan, dalam keadaan tunak, hanya beberapa komponen yang tetap konstan. Dalam keseimbangan, konsentrasi komponen konstan karena laju reaksi sama dengan reaksi maju dan mundur. Dalam kondisi tunak, hanya beberapa komponen yang konstan karena laju sintesis dan laju konsumsi sama. Untuk ini, reaksi tidak harus dalam keseimbangan.
Ringkasan -Keseimbangan vs Steady State
Keseimbangan dan kondisi mapan adalah konsep kimia yang penting. Perbedaan utama antara keseimbangan dan kondisi tunak adalah bahwa dalam keseimbangan, konsentrasi semua komponen tetap konstan sedangkan, dalam keadaan tunak, hanya beberapa komponen yang tetap konstan.
Referensi:
1.Helmenstine, Anne Marie. “Keseimbangan kimia dalam reaksi kimia."Thoughtco, Feb. 3, 2019, tersedia di sini.
Gambar milik:
1. “CNX Chem 05 01 HeatTrans1” oleh OpenStax - (CC oleh 4.0) Via Commons Wikimedia


