Perbedaan antara energi ionisasi pertama dan kedua (I1E vs I2E)
Perbedaan Utama - Energi ionisasi kedua vs kedua (I1E vs I2E)
Sebelum menganalisis perbedaan antara energi ionisasi pertama dan kedua, mari kita mendiskusikan apa itu energi ionisasi. Secara umum, energi ionisasi disebut sebagai energi yang diperlukan untuk menghilangkan elektron dari atom gas atau ion. Karena elektron tertarik pada nukleus positif, energi perlu dipasok untuk proses ini. Ini dianggap sebagai proses endotermik. Energi ionisasi diekspresikan dalam kJ mol-1. Itu perbedaan utama Antara energi ionisasi pertama dan kedua paling baik dijelaskan dalam definisi mereka; Energi yang diserap oleh atom gas netral untuk menghasilkan ion bermuatan +1 (untuk menghilangkan elektron) disebut Energi ionisasi pertama sedangkan Energi yang diserap oleh ion gas bermuatan positif (+1) untuk menghasilkan ion dengan muatan +2 disebut energi ionisasi kedua. Energi ionisasi dihitung untuk 1 mol atom atau ion. Dengan kata lain; Energi ionisasi pertama berkaitan dengan atom gas netral dan energi ionisasi kedua terkait dengan ion gas dengan muatan (+1). Besarnya energi ionisasi bervariasi tergantung pada muatan nukleus, jarak bentuk elektron nukleus dan jumlah elektron antara nukleus dan elektron cangkang luar.
Apa energi ionisasi pertama (i1E)?
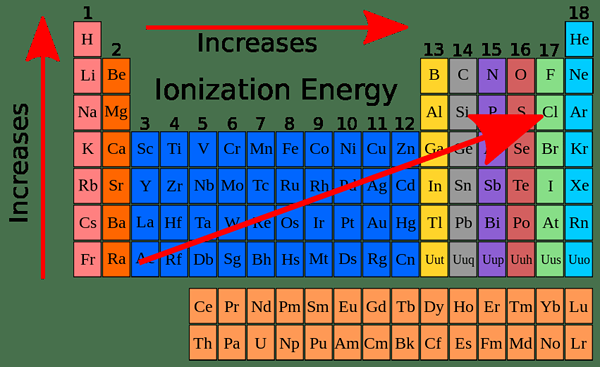
Energi ionisasi pertama didefinisikan sebagai energi yang diserap oleh 1 mol atom gas netral untuk menghilangkan elektron yang paling longgar dari atom untuk menghasilkan 1 mol ion gas dengan muatan +1. Besarnya energi ionisasi pertama meningkat sepanjang periode dalam tabel periodik dan berkurang di sepanjang kelompok. Energi ionisasi pertama memiliki periodisitas; itu memiliki pola yang sama berulang kali di sepanjang tabel periodik.
Apa energi ionisasi kedua (i2E)?
Energi ionisasi kedua didefinisikan sebagai energi yang diserap oleh 1 mol ion gas bermuatan positif untuk menghasilkan 1 mol ion gas dengan muatan +2, dengan menghilangkan elektron yang terikat secara longgar dari ion +1. Energi ionisasi kedua juga menunjukkan periodisitas. 
Apa perbedaan antara energi ionisasi pertama dan kedua (i1E dan i2E)?
Definisi Energi ionisasi pertama dan kedua
Energi ionisasi pertama (i1E): Energi yang dibutuhkan untuk menghilangkan elektron yang paling longgar dari 1 mol atom gas untuk menghasilkan 1 mol ion gas dengan muatan positif (+1).
X (G) X+ (G) + e-
(1 mol) (1 mol) (1 mol)
Energi ionisasi kedua (i2E): Energi yang dibutuhkan untuk menghilangkan elektron yang paling longgar dari 1 mol ion gas dengan muatan +1 untuk menghasilkan mol ion gas dengan muatan +2.
X+ (G) X2+ (G) + e-
(1 mol) (1 mol) (1 mol)
Karakteristik energi ionisasi pertama dan kedua
Persyaratan Energi
Biasanya mengeluarkan elektron pertama dari atom gas keadaan tanah lebih mudah daripada mengeluarkan elektron kedua dari ion bermuatan positif. Oleh karena itu, Energi ionisasi pertama kurang dari energi ionisasi kedua dan perbedaan energi antara energi ionisasi pertama dan kedua secara signifikan besar.
| Elemen | Energi ionisasi pertama (i1E) /KJ Mol-1 | Energi ionisasi kedua (i2E) / kJ mol-1 |
| Hidrogen (H) | 1312 | |
| Helium (dia) | 2372 | 5250 |
| Lithium (Li) | 520 | 7292 |
| Berilium (be) | 899 | 1757 |
| Boron (b) | 800 | 2426 |
| Karbon (C) | 1086 | 2352 |
| Nitrogen (n) | 1402 | 2855 |
| Oksigen (o) | 1314 | 3388 |
| Fluor (f) | 680 | 3375 |
| Neon (NE) | 2080 | 3963 |
| Sodium (NA) | 496 | 4563 |
| Magnesium (MG) | 737 | 1450 |
Tren energi ionisasi dalam tabel periodik
Energi ionisasi pertama (i1E): Nilai energi ionisasi pertama atom dalam setiap periode menunjukkan variasi yang sama. Besarnya selalu kurang dari nilai energi ionisasi kedua
Energi ionisasi kedua (i2E): Nilai energi ionisasi kedua dari atom dalam setiap periode menunjukkan variasi yang sama; Nilai -nilai tersebut selalu lebih tinggi dari nilai energi ionisasi pertama.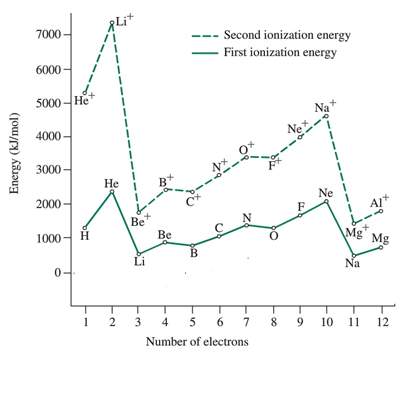 Gambar milik:
Gambar milik:


