Perbedaan antara larutan jenuh dan jenuh

Perbedaan utama - solusi jenuh vs superst jenuh
Mari kita lihat secara singkat konsep saturasi sebelum beralih ke analisis kompleks perbedaan antara solusi jenuh dan jenuh. Solusi dibuat dengan melarutkan zat terlarut dalam pelarut. Dua sifat kimia "saturasi" dan "jenuh" dalam pelarut terutama tergantung pada kelarutan zat terlarut dalam pelarut. Pada suhu tertentu, kelarutan zat terlarut dalam pelarut tertentu adalah konstan (q).
Q didefinisikan sebagai produk ion dari zat terlarut.
Contoh: Kelarutan agcl dalam air (qAgcl) = [Ag+] [Cl-]
Secara umum, jika kita terus menambahkan zat terlarut ke dalam pelarut, ada jumlah maksimum yang dapat kita tambahkan larut dalam pelarut. Setelah batas tertentu, zat terlarut mulai mengendap dalam pelarut. Itu menjadi solusi jenuh setelah batas ini. Itu disebut solusi jenuh ketika kita dapat melarutkan zat terlarut tanpa pembentukan endapan.
Itu perbedaan utama antara Saturasi dan jenuh adalah itu, Saturasi adalah keadaan di mana solusi suatu zat tidak dapat melarutkan tidak lebih dari zat itu, dan jumlah tambahannya akan muncul sebagai fase terpisah sementara supersaturasi adalah keadaan dari solusi yang mengandung lebih banyak bahan terlarut daripada yang dapat dilarutkan oleh oleh pelarut dalam keadaan normal.
Apa itu solusi jenuh?
Ada sejumlah senyawa yang sangat terbatas yang larut dalam waktu yang tak terbatas dalam pelarut; Yang berarti, kita dapat mencampur zat terlarut dalam pelarut dalam proporsi apa pun untuk larut tanpa membentuk endapan. Namun, sebagian besar zat terlarut tidak terlalu tidak larut; Mereka membentuk endapan jika Anda menambahkan lebih banyak zat terlarut ke dalam pelarut.
Larutan jenuh mengandung jumlah maksimum molekul zat terlarut yang dapat larut tanpa curah hujan.
Apa itu solusi jenuh?
Solusi tak jenuh tunggal terbentuk jika Anda menambahkan zat terlarut tambahan ke solusi jenuh. Dengan kata lain, ini adalah kondisi dalam solusi jenuh, ketika Anda menambahkan beberapa jumlah zat terlarut ke dalam solusi. Maka itu akan mulai membentuk endapan dalam larutan karena pelarut telah melampaui jumlah maksimum molekul zat terlarut yang dapat larut. Jika Anda menaikkan suhu pelarut, Anda dapat membuat larutan jenuh dengan melarutkan molekul zat terlarut.

Supersaturasi gula dalam air memungkinkan permen batu terbentuk.
Apa perbedaan antara larutan jenuh dan jenuh?
Definisi solusi jenuh dan jenuh
Solusi jenuh: Pada suhu tertentu, larutan dikatakan sebagai larutan jenuh, jika mengandung molekul zat terlarut yang dapat dipegang pelarut.
Solusi jenuh super: Pada suhu tertentu, larutan dikatakan sebagai solusi jenuh jika mengandung lebih banyak molekul zat terlarut yang dapat larut.
Penjelasan Kimia
Untuk solusi jenuh; Q = ksp (Tidak ada presipitasi)
Untuk solusi jenuh super; Q> ksp (Endapan akan terbentuk)
Di mana;
Q = kelarutan (hasil bagi reaksi)
K sp= Produk kelarutan (Produk matematika konsentrasi ion terlarut yang diangkat ke kekuatan koefisien stoikiometrik mereka)
Contoh: Pertimbangkan melarutkan perak klorida (AGCL) dalam air.
AgCl - Solute and Water - Solvent

Agcl telah larut dalam air Sejumlah besar AgCl telah larut dalam air.
Solusinya jelas endapan terlihat jelas
Q = [AG+] [Cl-] = Ksp Q = [AG+] [Cl-]> Ksp
Di mana,
[Ag+] = Konsentrasi Ag+ di dalam air
[Cl-] = Konsentrasi cl- di dalam air
Untuk agcl, ksp = 1.8 × 10-10 mol2DM-6
Bagaimana kita bisa membuat solusi jenuh dan jenuh?
Solusi jenuh dan jenuh terbentuk terbentuk saat Anda terus menambahkan zat terlarut ke dalam pelarut. Pada suhu tertentu, pertama, itu membentuk larutan tak jenuh dan kemudian, larutan jenuh dan akhirnya larutan jenuh.
Contoh: Melarutkan garam dalam air
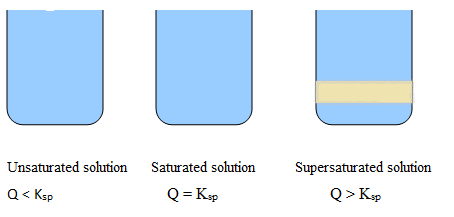 Solusi tak jenuh: Lebih sedikit jumlah garam dalam air, larutan bening, tidak ada presipitasi.
Solusi tak jenuh: Lebih sedikit jumlah garam dalam air, larutan bening, tidak ada presipitasi.
Solusi jenuh: Jumlah maksimum garam dilarutkan dalam air, warna larutan sedikit berubah, tetapi tidak ada curah hujan.
Solusi jenuh super: Lebih banyak garam dilarutkan dalam air, larutan berawan, presipitasi terlihat.
Gambar milik:
"Rock-Candy-Sticks" oleh Evan-Amos-karya sendiri. (CC BY-SA 3.0) Via Commons


