Perbedaan antara isotonik dan hipertonik
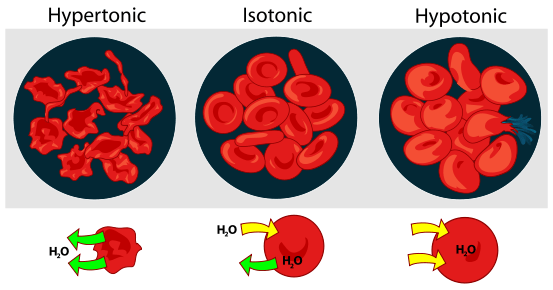
Perbedaan utama - isotonik vs hipertonik
Penting untuk memahami konsep tonisitas sebelum menganalisis perbedaan antara isotonik dan hipertonik. Oleh karena itu, mari kita jelaskan secara singkat konsep tonisitas dan kepentingannya. Tonisitas adalah varian dalam konsentrasi air dari dua solusi dibagi dengan membran semipermeabel. Ini juga dapat dijelaskan sebagai konsentrasi air relatif dari larutan yang menentukan arah dan jumlah difusi air sampai mencapai konsentrasi yang sama di kedua sisi membran. Dengan mengidentifikasi tonikitas solusi, kita dapat menentukan ke arah mana air akan tersebar. Fenomena ini umumnya digunakan ketika menggambarkan respons sel yang direndam dalam larutan eksternal. Ada tiga klasifikasi tonikitas yang satu solusi dapat memiliki relatif terhadap yang lain.Mereka hipertonik, hipotonik, dan isotonik. Itu perbedaan utama Antara isotonik dan hipertonik adalah itu Solusi hipertonik mengandung lebih banyak pelarut daripada zat terlarut sedangkan Zat terlarut dan pelarut didistribusikan secara merata dalam solusi isotonik. Namun, menghafal definisi solusi hipertonik dan isotonik tidak penting jika kita dapat memahami perbedaan antara solusi isotonik dan hipertonik.
Apa itu hipertonik?
Hyper adalah kata lain untuk di atas atau berlebihan. Larutan hipertonik akan memiliki konsentrasi zat terlarut yang lebih tinggi (glukosa atau garam) daripada sel. Solut adalah elemen yang dilarutkan dalam pelarut, sehingga membentuk solusi. Dalam larutan hipertonik, konsentrasi zat terlarut lebih besar di luar sel daripada di dalamnya. Ketika sel direndam dalam larutan hipertonik akan ada pergeseran osmotik dan molekul air akan mengalir keluar dari sel untuk menyeimbangkan konsentrasi zat terlarut dan akan ada penyusutan dalam ukuran sel.
Apa isotonik?
ISO adalah kata lain untuk yang sama dan tonik adalah untuk tonikitas solusi. Solusi isotonik akan memiliki konsentrasi zat terlarut yang serupa daripada solusi yang dibandingkan dengan. Dalam larutan isotonik, konsentrasi zat terlarut adalah sama baik di dalam maupun di luar sel yang menciptakan keseimbangan dalam lingkungan organisasi seluler. Ketika sel direndam dalam larutan isotonik, tidak akan ada pergeseran osmotik dan molekul air difus melalui membran sel di kedua arah untuk menyeimbangkan konsentrasi zat terlarut. Proses ini tidak akan membuat pembengkakan atau menyusutnya sel.
Apa perbedaan antara isotonik dan hipertonik?
Perbedaan antara hipertonik dan isotonik dapat diklasifikasikan ke dalam kategori berikut.
Definisi Isotonik dan hipertonik
Hypertonic: "Hyper" dikenal sebagai di atas atau + "tonik" yang berlebihan dikenal sebagai sesuatu di sepanjang garis solusi. Dengan demikian, hipertonik menunjukkan peningkatan tonisitas larutan.
Isotonik: "ISO" dikenal sebagai + "tonik" yang sama dikenal sebagai sesuatu di sepanjang garis solusi. Dengan demikian, isotonik menyarankan tonisitas solusi yang serupa.
Karakter dari Isotonik dan hipertonik
Konsentrasi zat terlarut dan larutan
Hypertonic: Solusi mengandung lebih banyak pelarut daripada zat terlarut.
Isotonik: Zat terlarut dan pelarut dalam solusi didistribusikan dengan cara yang sama.
Contoh
Hypertonic: Air murni, karena tidak ada/kurang zat terlarut yang dilarutkan dalam air murni, dan konsentrasinya sangat rendah dibandingkan dengan lingkungan seluler.
Isotonik: Larutan garam adalah isotonik untuk plasma darah manusia
Respon sel dalam solusi hipertonik dan isotonik (Lihat Gambar 1)
Hypertonic: Ketika sel biologis berada dalam lingkungan hipertonik, air mengalir melintasi membran sel keluar dari sel, untuk menyeimbangkan konsentrasi zat terlarut di kedua sel dan lingkungan di sekitar sel. Akibatnya, sel akan menyusut Saat air meninggalkan sel untuk mengurangi konsentrasi zat terlarut yang lebih tinggi di lingkungan luar.
Isotonik: Saat sel dalam solusi isotonik, itu tidak akan membuat pembengkakan atau menyusutnya sel.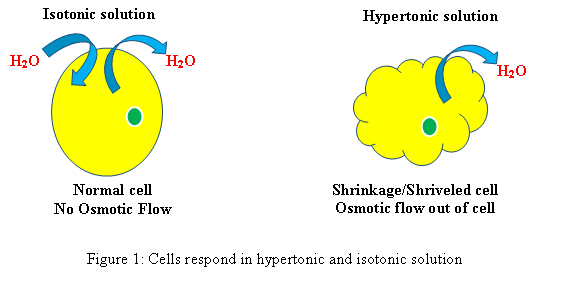
Gradien konsentrasi air
Hypertonic: Gradien konsentrasi air dapat diamati dari bagian dalam sel ke larutan hipertonik
Isotonik: Gradien konsentrasi air tidak ada
Gradien konsentrasi zat terlarut
Hypertonic: Gradien konsentrasi zat terlarut terlihat dari larutan hipertonik ke dalam sel
Isotonik: Gradien konsentrasi terlarut tidak ada.
Pergeseran osmotik
Hypertonic: Pergeseran osmotik ada.
Isotonik: Pergeseran osmotik tidak ada
Pergerakan air
Hypertonic: Molekul air bergerak atau berdifusi dengan cepat dari dalam sel ke arah larutan luar, dan dengan demikian sel akan kehilangan air.
Isotonik: Molekul air bergerak atau menyebar di kedua arah, dan laju difusi air serupa di setiap arah. Dengan demikian sel akan mendapatkan atau kehilangan air.
Minuman olahraga
Isotonik: Minuman isotonik terdiri dari konsentrasi garam, karbohidrat gula dan elektrolit yang serupa seperti dalam tubuh manusia. Minuman olahraga isotonik sering lebih disukai sebagai solusi rehidrasi oral. Biasanya memiliki 4-8g karbohidrat per 100 ml.
Hypertonic: Minuman hipertonik terdiri dari konsentrasi garam, gula karbohidrat dan elektrolit yang lebih tinggi seperti pada tubuh manusia. Biasanya memiliki sekitar 8g karbohidrat per 100 ml. Solusi hipertonik juga digunakan dalam osmotherapy untuk mengelola perdarahan otak. Minuman olahraga hipertonik sangat ideal bagi mereka yang membutuhkan tingkat energi yang sangat tinggi.
Kesimpulannya, ada tiga bentuk solusi yang didasarkan pada konsentrasi zat terlarut dan mereka isotonik, hipotonik, dan hipertonik. Konsentrasi zat terlarut adalah sama baik di dalam maupun di luar sel dalam larutan isotonik. Konsentrasi zat terlarut lebih besar di dalam sel daripada lingkungan luar dalam larutan hipotonik sedangkan larutan hipertonik adalah di mana konsentrasi zat terlarut lebih besar dari lingkungan luar daripada di dalam sel.
Referensi mansoor, m. A., Beverly, J., dan Sandmann. (2002). Apotek fisik terapan. McGraw-Hill Professional. pp. 54-57. Voet, d., Judith, g. V. dan Charlotte, W. P. (2001). Dasar -dasar Biokimia (Rev.ed.). New York: Wiley. P.30. Gambar milik: “Tekanan osmotik pada diagram sel darah” oleh Ladyofhats - lakukan sendiri berdasarkan [1], [2], [3] dan [4]… (domain publik) melalui Wikimedia Commons


