Perbedaan antara fluor dan fluoride

Itu perbedaan utama antara fluor dan fluoride adalah itu Fluorin netral sedangkan fluoride bermuatan negatif.
Elemen dalam tabel periodik kecuali gas mulia tidak stabil. Oleh karena itu, elemen mencoba bereaksi dengan elemen lain untuk mendapatkan konfigurasi elektron gas mulia dan mencapai stabilitas. Fluor adalah elemen yang juga harus mendapatkan elektron untuk mencapai konfigurasi elektron gas mulia, neon. Semua logam bereaksi dengan fluor, membentuk fluorida. Oleh karena itu, ada perbedaan antara fluor dan fluoride tergantung pada sifat fisik dan kimianya karena perubahan satu elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu fluor
3. Apa itu fluoride
4. Perbandingan berdampingan - fluor vs fluoride dalam bentuk tabel
5. Ringkasan
Apa itu fluor?
Fluor adalah elemen dalam tabel periodik, yang dilambangkan dengan f. Ini adalah halogen (kelompok ke -17) pada periode ke -2 dari tabel periodik. Jumlah atom fluor adalah 9; Dengan demikian, ia memiliki sembilan proton dan sembilan elektron. Konfigurasi elektronnya ditulis sebagai 1s2 2s2 2p5. Karena S Sublevel harus memiliki 6 elektron untuk mendapatkan neon, konfigurasi elektron gas mulia, fluor memiliki kemampuan untuk menarik elektron. Menurut skala Pauling, fluor memiliki elektronegativitas tertinggi dalam tabel periodik, yaitu sekitar 4.
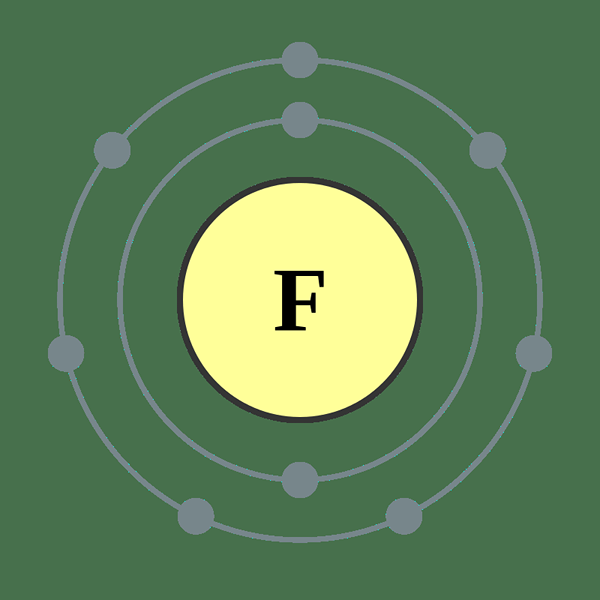
Gambar 01: Atom fluorine
Massa atom fluor adalah 18.9984 AMU. Pada suhu kamar, ada fluor sebagai molekul diatomik (F2). F2 adalah gas warna kuning -kuning pucat dan memiliki titik leleh -219 ° C dan titik didih -188 ° C. Di antara isotop fluor, F-17 bukan isotop yang stabil dan memiliki waktu paruh 1.8 jam. Tapi F-19 adalah isotop yang stabil. Kelimpahan F-19 di Bumi adalah 100%. Fluor dapat mengoksidasi oksigen dan keadaan oksidasi adalah -1.
Gas fluor lebih padat dari udara dan juga dapat dicairkan dan dipadatkan. Ini sangat reaktif, dan ini disebabkan oleh elektronegativitas yang tinggi dan ikatan fluorin-fluorin yang lemah. Selain itu, reaksi spesies kimia ini dengan sebagian besar molekul lain cepat. Karena reaktivitas, itu tidak ditemukan sebagai elemen bebas.
Apa itu fluoride?
Fluoride adalah anion yang terbentuk saat fluorat mengabstraksi elektron dari elemen elektropositif lain. Kita bisa mewakilinya dengan simbol f-. Ini adalah ion monovalen dengan muatan -1. Oleh karena itu, ia memiliki 10 elektron dan sembilan proton. Selain itu, konfigurasi elektron fluoride adalah 1s2 2s2 2p6.

Gambar 02: Fluoride yang mengandung pasta gigi
Fluoride ada dalam senyawa ionik seperti natrium fluorida, kalsium fluorida (fluorit) dan HF. Itu juga ada secara alami dalam sumber air. Diketahui bahwa ion ini membantu mencegah kerusakan gigi; Oleh karena itu, ditambahkan ke pasta gigi.
Apa perbedaan antara fluor dan fluoride?
Fluor adalah elemen kimia sementara fluoride adalah anion yang terbentuknya. Perbedaan utama antara fluor dan fluoride adalah bahwa fluorin netral sedangkan fluoride bermuatan negatif. Fluor adalah elemen dalam tabel periodik yang dilambangkan dengan F sedangkan fluoride adalah anion yang memiliki simbol f-. Selain itu, tidak ada elektron yang tidak berpasangan dalam fluoride, tetapi ada satu elektron yang tidak berpasangan dalam atom fluorin. Perbedaan lain antara fluor dan fluoride adalah bahwa elemen bebas fluor tidak terjadi secara alami, tetapi fluoride secara alami terjadi dalam sumber air.
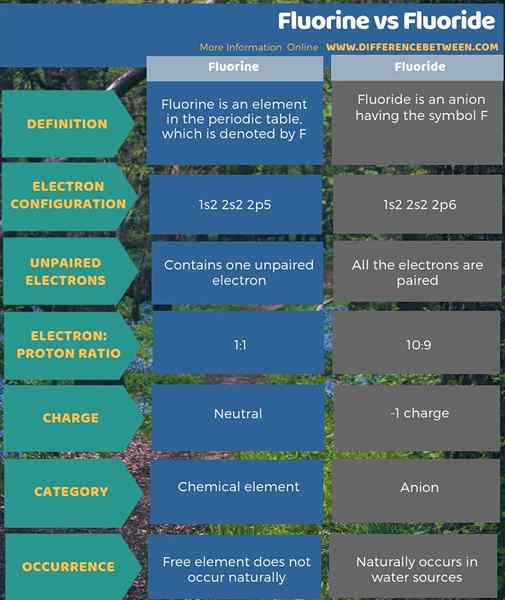
Ringkasan -fluor vs fluoride
Pada dasarnya, fluor adalah elemen kimia sedangkan fluoride adalah anion yang terbentuk. Perbedaan utama antara fluor dan fluoride adalah bahwa fluorin netral sedangkan fluoride bermuatan negatif.
Referensi:
1. Miller, Bruce G. “Pengaruh penggunaan batubara pada kesehatan manusia dan lingkungan.Teknologi Teknik Batubara Bersih, 2017, PP. 105-144., doi: 10.1016/B978-0-12-811365-3.00003-x.
Gambar milik:
1. “Electron Shell 009 Fluorine - No Label” oleh Pumbaa (karya asli oleh Greg Robson) - File: Electron Shell 009 Fluorine.SVG, (CC BY-SA 2.0 uk) via commons wikimedia
2. "Pasta gigi" oleh William Warby (CC oleh 2.0) Via Flickr


