Perbedaan antara massa unit formula dan massa molekul
Perbedaan Utama - Formula Massa satuan vs massa molekul
Massa unit formula atau massa formula suatu senyawa adalah massa formula empiris senyawa itu. Formula empiris suatu senyawa adalah formula kimia yang memberikan rasio antara atom yang berbeda yang ada dalam senyawa itu dalam bilangan bulat kecil. Dengan kata lain, ini adalah rasio paling sedikit antara elemen kimia dalam suatu senyawa. Itu tidak memberikan jumlah aktual dari setiap elemen kimia. Ketika massa formula ini diukur, dikenal sebagai massa unit formula. Massa molekul senyawa adalah massa molekul zat tertentu. Sebagian besar waktu, istilah massa molar dan massa molekul digunakan secara bergantian, meskipun mereka adalah istilah yang berbeda. Massa molar adalah massa mol zat sedangkan massa molekul bukanlah massa mol zat. Untuk molekul sederhana, massa formula dan massa molekul adalah sama. Tetapi untuk senyawa kompleks, ada perbedaan besar antara dua nilai. Itu perbedaan utama Antara unit rumus massa dan massa molekul adalah itu Nilai massa unit formula selalu lebih kecil atau mirip dengan massa molekul zat yang sama sedangkan nilai massa molekul selalu lebih besar atau mirip dengan massa unit formula dari zat yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu massa unit formula
3. Apa itu massa molekul
4. Kesamaan antara massa unit formula dan massa molekul
5. Perbandingan berdampingan - massa unit rumus vs massa molekul dalam bentuk tabel
6. Ringkasan
Apa itu massa unit formula?
Massa unit formula atau massa formula adalah massa formula empiris zat tertentu. Ini berarti, itu adalah jumlah massa atom dari unsur -unsur kimia yang ada dalam formula empiris. Formula empiris adalah formula kimia zat yang memberikan rasio paling sederhana antara unsur kimia yang ada dalam suatu zat. Misalnya, formula empiris untuk c6H12HAI6 (glukosa) adalah ch2HAI. Mari kita pertimbangkan beberapa contoh untuk memahami konsepnya.
Perhitungan massa unit formula
Massa unit formula senyawa sederhana
Untuk senyawa sederhana seperti NaCl (natrium klorida), formula empiris dan formula molekul adalah sama. Nilai massa unit formula adalah,
(Massa atom Na) + (massa atom cl) = (23 + 35.5) Amu = 58.5 Amu
Massa unit formula senyawa kompleks
Untuk senyawa kompleks seperti c11H22HAI11 (sukrosa), formula empiris adalah ch2 Maka massa unit formula adalah,
(Massa atom C) + 2 (massa atom H) + (massa atom O) = (12 + 2 × 1 + 16) amu = 30 amu.
Untuk senyawa polimer, massa unit formula adalah massa unit berulang. Polimer adalah makromolekul yang terbuat dari banyak jumlah senyawa kecil yang dikenal sebagai monomer. Unit berulang mewakili monomer atau monomer yang digunakan untuk menghasilkan senyawa polimer. Oleh karena itu, setara dengan formula empiris senyawa kompleks.
Apa itu massa molekul?
Massa molekul adalah massa molekul zat tertentu. Ini juga dikenal sebagai berat molekul. Berat molekul dihitung sebagai jumlah massa atom dari semua elemen kimia yang ada dalam molekul dengan mempertimbangkan rasio aktual antara unsur -unsur tersebut.
Oleh karena itu, untuk senyawa yang besar dan kompleks, nilai massa unit formula selalu lebih besar dari massa molekul. Tapi untuk molekul kecil dan sederhana, keduanya bisa sama.
Perhitungan massa molekul
Mari kita pertimbangkan beberapa contoh untuk memahami metode perhitungan.
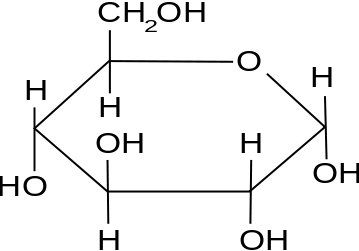
Contoh: Glukosa
Formula kimia glukosa adalah C6H12HAI6. Oleh karena itu berat molekul glukosa,
6 (massa atom C) + 12 (massa atom H) + 6 (massa atom O)
= 6 (12 amu) + 12 (1 amu) + 6 (16 amu)
= (72 + 12 + 96) amu
= 180 Amu.

Gambar 01: Molekul Glukosa
Contoh: kalsium karbonat
Formula kimia kalsium karbonat adalah Caco3 , yang juga merupakan formula empiris dari senyawa itu. Oleh karena itu, berat molekul kalsium karbonat adalah,
(Massa atom Ca) + (massa atom C) + 3 (massa atom O)
= (40 + 12 + 3 x 16) amu
= 100 AMU
Apa kesamaan antara massa unit formula dan massa molekul?
- Massa unit formula dan massa molekul adalah pengukuran berat zat.
- Massa unit rumus dan massa molekul memiliki unit pengukuran yang sama.
Apa perbedaan antara massa unit formula dan massa molekul?
Massa unit formula vs massa molekul | |
| Massa unit formula atau massa formula adalah massa formula empiris zat tertentu. | Massa molekul adalah massa molekul dalam zat tertentu. |
| Nilai | |
| Nilai massa unit formula selalu lebih kecil atau mirip dengan massa molekul zat yang sama. | Nilai massa molekul selalu lebih besar atau mirip dengan massa unit formula dari zat yang sama. |
Ringkasan -Formula Massa satuan vs massa molekul
Massa unit formula adalah massa formula empiris zat tertentu. Massa molekul suatu zat adalah massa aktual dari molekul suatu zat tertentu. Perbedaan antara massa unit formula dan massa molekul adalah bahwa nilai massa unit formula selalu lebih kecil atau mirip dengan massa molekul dari zat yang sama sedangkan nilai massa molekul selalu lebih besar atau mirip dengan massa unit formula dari zat yang sama.
Referensi:
1.Helmenstine, Anne Marie, D. “Massa formula versus massa molekul."Thoughtco, mar. 25, 2017. Tersedia disini
2.“Massa molekul.”Wikipedia, Wikimedia Foundation, 25 Feb. 2018. Tersedia disini
3.“Formula empiris.”Wikipedia, Wikimedia Foundation, 18 Feb. 2018. Tersedia disini
Gambar milik:
1.'Alpha-D-Glucose Haworth'by Masur (Domain Publik) Via Commons Wikimedia


