Perbedaan antara radikal bebas dan ion
Itu perbedaan utama antara radikal bebas dan ion adalah bahwa Radikal bebas memiliki satu atau lebih elektron yang tidak berpasangan, tetapi ion telah memasangkan elektron.
Kita dapat menjelaskan perbedaan antara radikal bebas dan ion dari sifat dasar ion dan radikal bebas. Ion dapat terjadi sebagai molekul atau atom dengan muatan (positif atau negatif) karena kehilangan atau gain elektron. Ion memiliki muatan negatif karena gain elektron dan menahan muatan positif karena hilangnya elektron. Ion dapat terjadi sebagai spesies kimia tunggal atau bermuatan, tergantung pada jumlah elektron yang diperoleh atau hilang. Radikal bebas adalah molekul atau atom yang memiliki setidaknya satu elektron yang tidak berpasangan. Artikel ini adalah tentang perbedaan antara radikal bebas dan ion, termasuk karakteristik khusus mereka.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Radikal Gratis
3. Apa itu ion
4. Perbandingan berdampingan - radikal bebas vs ion dalam bentuk tabel
5. Ringkasan
Apa itu Radikal Gratis?
Radikal bebas adalah atom atau sekelompok atom yang mengandung satu atau lebih elektron yang tidak berpasangan. Mereka sangat reaktif karena adanya elektron yang tidak berpasangan. Radikal bebas sangat tidak stabil dan cobalah untuk mendapatkan stabilitas dengan menerima elektron yang dibutuhkan. Mereka bereaksi dengan senyawa kimia lainnya dengan menangkap elektron yang dibutuhkan. Radikal bebas adalah perantara penting dalam proses alami. Kita dapat menunjukkan radikal bebas dengan titik superskrip di sebelah kanan. Misalnya, h., Cl., Ho., H3C.
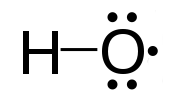
Gambar 01: radikal hidroksil
Radikal bebas berumur panjang ada dalam tiga kategori: radikal yang stabil, radikal persisten, dan di-radikal.
- Radikal yang stabil: Contoh utama radikal yang stabil adalah oksigen molekuler O2. Radikal organik yang mengandung sistem π terkonjugasi dapat lama hidup.
- Radikal yang persisten: Mereka berumur panjang karena crowding sterik di sekitar pusat radikal dan membuatnya sulit secara fisik untuk bereaksi dengan molekul lain.
- Di-radikal: Beberapa molekul memiliki dua pusat radikal, kami menyebutkannya sebagai di-radikal. Oksigen molekuler secara alami (oksigen atmosfer) ada sebagai diradikal.
Apa itu ion?
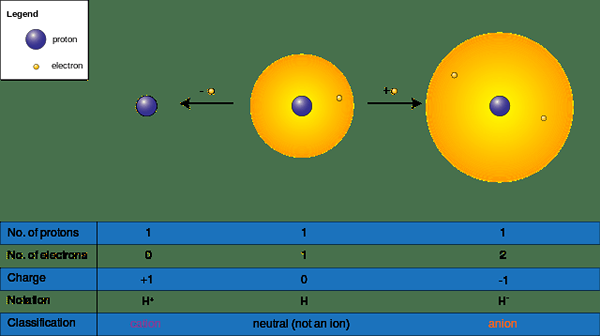
Ion dapat terbentuk ketika spesies kimia memperoleh atau kehilangan elektron dalam reaksi kimia; Mereka memiliki muatan positif (+) atau negatif (-). Mereka mendapatkan muatan negatif dengan menerima elektron dan muatan positif dengan menyumbangkan elektron ke molekul defisiensi elektron atau elemen. Menerima atau menyumbangkan elektron secara langsung mempengaruhi ukuran ion; itu mengubah ukuran molekul secara dramatis. Kami menyebutkan atom atau sekelompok atom tanpa muatan negatif atau positif sebagai "netral"; Untuk menjadi atom netral atau molekul, jumlah proton harus sama dengan sejumlah elektron.
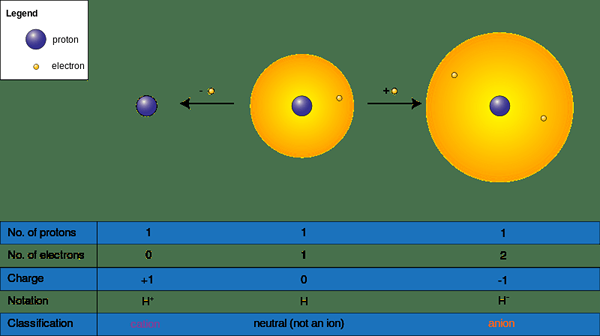
Gambar 02: Pembentukan Kation dan Anion
Oleh karena itu ada dua bentuk ion sebagai berikut.
- Kation atau (+) ion - Seringkali logam berada di bawah kategori ini karena logam kehilangan elektron menjadi positif (+) yang diisi (NA+, Ba2+, Ca2+, Al3+)
- Ion anion (-) - Seringkali non-logam berada di bawah kategori ini karena non-logam mendapatkan elektron menjadi negatif (-) bermuatan (cl-, S2-, HAI2-, Br-)
Apa perbedaan antara radikal bebas dan ion?
Perbedaan utama antara radikal bebas dan ion adalah bahwa radikal bebas memiliki satu atau lebih elektron yang tidak berpasangan, tetapi ion telah memasangkan elektron. Oleh karena itu, radikal bebas sangat tidak stabil sementara ion relatif stabil. Oleh karena itu, ini juga perbedaan yang signifikan antara radikal bebas dan ion. Namun, radikal dapat ada sendiri sementara sebagian besar ion dikombinasikan dengan ion yang bermuatan berlawanan. Saat mempertimbangkan lebih banyak tentang stabilitasnya, radikal bebas menjadi stabil dengan menerima elektron, tetapi ion stabil ketika mereka membentuk kompleks dengan senyawa bermuatan yang berlawanan.
Perbedaan penting lainnya antara radikal bebas dan ion adalah bahwa ion selalu memiliki muatan, tetapi radikal bebas bukan spesies yang diisi bahkan jika mereka memiliki elektron yang tidak berpasangan. Perbedaan ini muncul karena, dalam ion, jumlah total elektron selalu tidak sama dengan jumlah proton dalam nukleus saat berada dalam radikal bebas, jumlah elektron sama dengan jumlah proton.
Infografis di bawah ini memberikan rincian lebih lanjut tentang perbedaan antara radikal bebas dan ion.
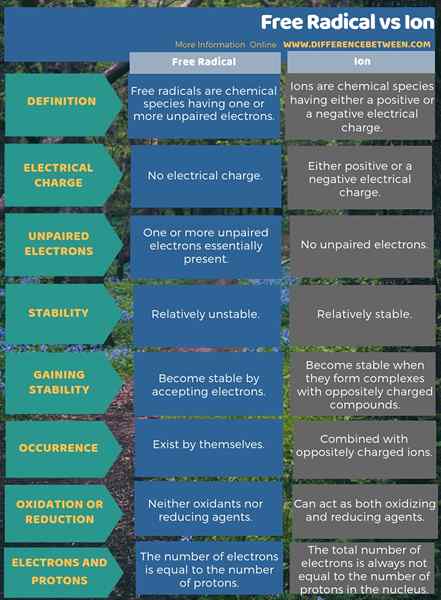
Ringkasan -radikal vs ion bebas
Kita dapat menggambarkan istilah, radikal bebas dan ion, menggunakan jumlah elektron milik spesies tertentu. Di sini, perbedaan paling signifikan antara radikal dan ion bebas adalah bahwa radikal bebas memiliki elektron yang tidak berpasangan tetapi, ion telah memasangkan elektron. Dengan demikian, radikal bebas lebih reaktif. Di sisi lain, ion menjadi stabil secara kimiawi dengan membentuk senyawa dengan ion/molekul bermuatan berlawanan.
Referensi:
1. “Radikal (Kimia)."Wikipedia, Wikimedia Foundation, 8 Okt. 2018. Tersedia disini
2. "Ion."Wikipedia, Wikimedia Foundation, 16 Okt. 2018. Tersedia disini
Gambar milik:
1."Hydroxyl Radical" oleh Smokeyjoe - karya sendiri, (CC BY -SA 4.0) Via Commons Wikimedia
2."Ion" oleh JKWCHUI - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


