Perbedaan antara asam nitrat marah dan asam nitrat pekat

Itu perbedaan utama antara asam nitrat yang marah dan asam nitrat pekat adalah bahwa Asam nitrat marah membentuk asap yang tidak berwarna, kekuningan atau kecoklatan sedangkan asam nitrat pekat biasanya tidak membentuk asap; tetapi konsentrasi asam ini sangat tinggi dapat memberikan asap berwarna putih.
Asam nitrat adalah asam yang sangat korosif dan berbahaya yang memiliki formula kimia HNO3. Selain itu, ia dapat memiliki sifat kimia encer atau terkonsentrasi. Either way, ia memiliki molekul asam nitrat yang dilarutkan dalam air. Reaksi antara nitrogen dioksida dan air membentuk asam nitrat. Tetapi dalam persiapan asam nitrat marah, kita dapat menyiapkannya dengan menambahkan kelebihan nitrogen dioksida ke asam nitrat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa asam nitrat marah
3. Apa itu asam nitrat terkonsentrasi
4. Perbandingan berdampingan - asam nitrat fuming vs asam nitrat pekat dalam bentuk tabel
5. Ringkasan
Apa asam nitrat marah?
Asam nitrat marah adalah tingkat asam nitrat komersial yang memiliki konsentrasi yang sangat tinggi dan kepadatan tinggi. Ini berisi 90-99% HNO3. Kita dapat menyiapkan cairan ini dengan menambahkan nitrogen dioksida yang berlebihan ke asam nitrat. Itu membentuk cairan fuming yang tidak berwarna, kekuningan atau kecoklatan yang sangat korosif. Oleh karena itu, larutan asam ini memiliki molekul gas dalam kombinasi dengan air; Tidak ada air di dalamnya. Asap asam ini naik dari permukaan asam; Ini mengarah pada namanya, "Fuming". Formula kimia senyawa ini adalah hno3-xTIDAK2.
Selain itu, ada dua bentuk utama asam ini sebagai asam nitrat putih dan merah. Oleh karena itu, kami menganggap asam fuming putih sebagai bentuk asam nitrat yang paling murni memiliki kurang dari 2%; Terkadang, tidak ada air sama sekali. Dengan demikian, sangat dekat dengan asam nitrat anhidrat, dan tersedia sebagai larutan 99%. Itu mengandung maksimal 0.5% nitrogen dioksida. Ini berguna sebagai pengoksidasi yang dapat disimpan dan propelan roket.

Gambar 01: Asam nitrat berkemah putih
Asam Nitrat Merah Fuming terdiri dari 90% HNO3. Ini memiliki kandungan nitrogen dioksida yang tinggi, yang membuat solusi muncul dalam warna coklat kemerahan. Itu memiliki kepadatan kurang dari 1.49 g/cm3. Jadi, ini juga berguna sebagai pengoksidasi yang dapat disimpan dan propelan roket. Untuk menyiapkan asam ini, kita dapat menggunakan asam nitrat 84% dan 13% dinitrogen tetroksida dengan 2% air.
Penggunaan:
- Asam Nitrat Merah Asam adalah komponen dari monopropellant.
- Berguna sebagai satu -satunya bahan bakar di roket.
- Sebagai pengoksidasi yang dapat disimpan.
- Asam nitrat putih marah digunakan dalam produksi bahan peledak. Contoh: Nitrogliserin.
Apa itu asam nitrat terkonsentrasi?
Asam nitrat terkonsentrasi hanyalah larutan yang mengandung lebih banyak asam nitrat dalam air yang lebih sedikit. Ini berarti bentuk terkonsentrasi dari asam ini mengandung jumlah air yang lebih sedikit dibandingkan dengan jumlah zat terlarut di dalamnya. Dalam skala komersial, 68% atau ke atas dianggap sebagai asam nitrat terkonsentrasi.

Gambar 02: 70% asam nitrat
Selain itu, kepadatan solusi ini adalah 1.35 g/cm3. Banyak konsentrasi ini tidak menghasilkan asap, tetapi konsentrasi asam ini sangat tinggi dapat memberikan asap berwarna putih. Kita dapat menghasilkan cairan ini melalui reaksi nitrogen dioksida dengan air.
Apa perbedaan antara asam nitrat marah dan asam nitrat pekat?
Asam nitrat marah adalah tingkat asam nitrat komersial yang memiliki konsentrasi yang sangat tinggi dan kepadatan tinggi. Selain itu, itu membentuk asap yang tidak berwarna, kekuningan atau kecoklatan. Konsentrasi terendah asam ini adalah 90%. Asam nitrat terkonsentrasi hanyalah larutan yang mengandung lebih banyak asam nitrat dalam air yang lebih sedikit. Konsentrasi asam terendah ini adalah 68%. Selain itu, asam ini biasanya tidak membentuk asap; Tetapi konsentrasi asam ini sangat tinggi dapat memberikan asap berwarna putih. Infografis berikut ini menyajikan lebih banyak rincian tentang perbedaan antara asam nitrat fum dan asam nitrat pekat.
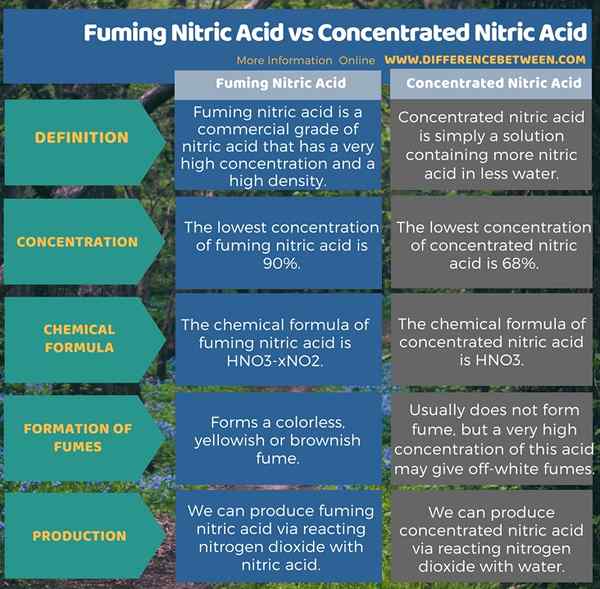
Ringkasan -Asam Nitrat Menggemukkan Vs Asam Nitrat Pekat
Ada dua bentuk asam nitrat dengan konsentrasi tinggi HNO3; mereka adalah asam nitrat yang marah dan asam nitrat pekat. Perbedaan utama antara asam nitrat fuming dan asam nitrat pekat adalah bahwa asam nitrat fuming membentuk fuming yang tidak berwarna, kekuningan atau kecoklatan sedangkan asam nitrat pekat biasanya tidak membentuk asap; tetapi konsentrasi asam ini sangat tinggi dapat memberikan asap berwarna putih.
Referensi:
1. "Asam sendawa.”Wikipedia, Wikimedia Foundation, 31 Juli 2018. Tersedia disini
2. "Asam sendawa."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
Gambar milik:
1.'Asam nitrat Fuming'by W. Oelen (CC BY-SA 3.0) Via Commons Wikimedia
2.'Asam Nitrat 70'by Aleksander Sobolewski via Wikimedia Commons, (CC BY-SA 4.0) Via Commons Wikimedia


