Perbedaan antara elemen Grup 1 dan Grup 2
Itu perbedaan utama Antara elemen Grup 1 dan Grup 2 adalah itu Semua elemen Grup 1 memiliki elektron yang tidak berpasangan di orbital terluar, sedangkan elemen kelompok 2 telah memasangkan elektron di orbital terluarnya.
Grup 1 dan 2 dari tabel periodik berisi elemen blok S. Itu berarti; Elemen -elemen ini memiliki elektron terluar di orbital S. Grup 1 dan 2 berbeda satu sama lain tergantung pada jumlah elektron di orbital terluarnya. Satu orbital hanya dapat berisi dua elektron karena jumlah kuantum magnetik dari orbital ini adalah 0.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elemen grup1
3. Apa itu Elemen Grup 2
4. Perbandingan berdampingan - elemen grup 1 vs grup 2 dalam bentuk tabel
5. Ringkasan
Apa itu Elemen Grup 1?
Elemen Grup 1 adalah elemen kimia yang memiliki elektron tidak berpasangan di orbital S terluar. Ini adalah kolom pertama dari blok S dari tabel periodik. Itu mengandung logam hidrogen dan alkali. Anggota Grup 1 ini adalah sebagai berikut:
- Hidrogen (H)
- Lithium (Li)
- Sodium (NA)
- Kalium (k)
- Rhubidium (RH)
- Cesium (CS)
- Francium (FR)

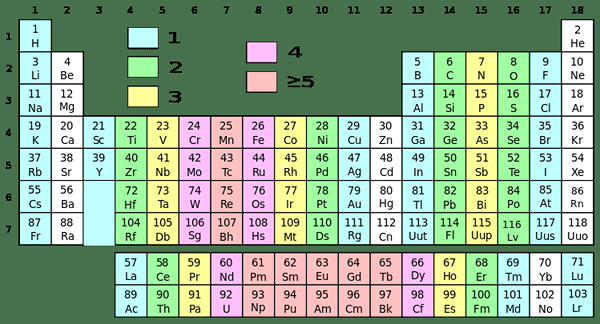
Gambar 01: Tabel periodik dengan kelompok yang berbeda dalam warna yang berbeda
Meskipun hidrogen ada dalam kelompok ini karena konfigurasi elektronnya, ia memiliki karakteristik yang berbeda dari logam alkali. Misalnya, ada hidrogen sebagai gas, sedangkan elemen lain dalam kelompok ini adalah logam. Logam ini semuanya berkilau, sangat reaktif, dan sangat lembut (kita dapat dengan mudah memotongnya menggunakan pisau sederhana).
Secara umum, elemen Grup 1 menunjukkan kepadatan rendah, titik leleh rendah, titik didih rendah dan memiliki struktur kristal kubik yang berpusat pada tubuh. Selain itu, mereka memiliki warna api yang berbeda, sehingga kami dapat dengan mudah membedakannya dengan mengekspos sampel ke pembakar bunsen. Saat turun kelompok logam alkali, ada beberapa variasi periodik seperti yang tercantum di bawah ini.
- Ukuran atom meningkat
- Titik lebur dan titik didih menurun karena kemampuan untuk membentuk ikatan yang kuat menurun ke dalam kelompok (ketika atom menjadi besar, ikatan yang terbentuk lemah).
- Kepadatan meningkat.
- Energi ionisasi pertama berkurang karena pada atom besar, elektron terluar terikat secara longgar dan dapat dengan mudah dihilangkan.
- Elektronegativitas
- Reaktivitas berkurang.
- Logam alkali memiliki afinitas elektron yang rendah dari elemen lainnya.
Apa itu Elemen Grup 2?
Grup 2 Elemen adalah elemen kimia yang memiliki pasangan elektron terluar dalam orbital S. Oleh karena itu, elektron valensi mereka dalam bentuk NS2. Selanjutnya, grup ini adalah kolom kedua dari blok S. Kami menamai mereka sebagai logam bumi alkali. Anggota grup ini adalah sebagai berikut:
- Berilium (be)
- Magnesium (MG)
- Kalsium (CA)
- Strontium (SR)
- Barium (BA)
- Radium (RA)
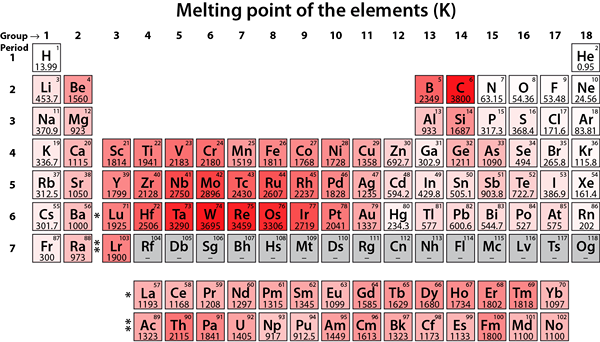
Gambar 02: Titik lebur elemen
Elemen logam ini cenderung menstabilkan konfigurasi elektron mereka dengan melepas dua elektron S terluar untuk mendapatkan konfigurasi elektron gas mulia. Oleh karena itu, elemen -elemen ini cenderung membentuk +2 kation. Logam ini kurang reaktif dibandingkan dengan elemen Grup 1. Selain itu, elemen -elemen ini memiliki titik leleh yang lebih tinggi dibandingkan dengan elemen kelompok 1, dan hidroksida mereka relatif kurang mendasar.
Apa perbedaan antara elemen Grup 1 dan Grup 2?
Grup 1 dan 2 berbeda satu sama lain tergantung pada jumlah elektron di orbital terluarnya. Perbedaan utama antara elemen Grup 1 dan Grup 2 adalah bahwa semua elemen Grup 1 memiliki elektron yang tidak berpasangan di orbital terluar, sedangkan elemen Grup 2 telah memasangkan elektron di orbital terluarnya.
Infografis di bawah ini menunjukkan lebih banyak perbandingan mengenai perbedaan antara elemen Grup 1 dan Grup 2.
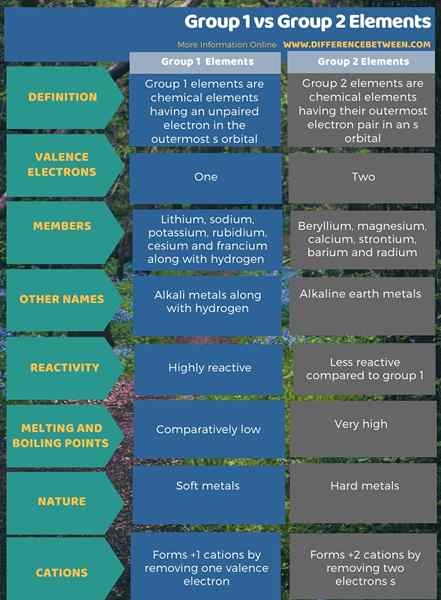
Ringkasan -Elemen Grup 1 Vs Grup 2
Grup 1 dan 2 berbeda satu sama lain tergantung pada jumlah elektron di orbital terluarnya. Perbedaan utama antara elemen Grup 1 dan Grup 2 adalah bahwa semua elemen Grup 1 memiliki elektron yang tidak berpasangan di orbital terluar, sedangkan elemen Grup 2 telah memasangkan elektron di orbital terluarnya.
Referensi:
1.“Kelompok 1: Hidrogen dan Logam Alkali.”Kimia Libretexts, Libretexts, 23 Juni 2019, tersedia di sini.
2. Helmenstine, Anne Marie. “Tabel berkala dari kelompok elemen."Thoughtco, Nov. 11, 2019, tersedia di sini.
Gambar milik:
1. “Tabel Periodik dengan Elektron Tidak Berpasangan” oleh KES47-Versi SVG dari gambar JPG yang dibuat oleh SA2020 pada 2009-02-03: File: Tabel Periodik dengan E tidak berpasangan-.jpg, (domain publik) via commons wikimedia
2. “Point of the Elements (K)” oleh Albris - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


