Perbedaan antara angka kuantum magnetik dan angka kuantum putaran
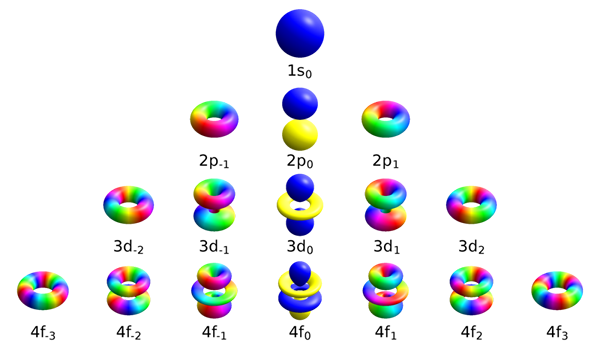
Itu perbedaan utama Antara angka kuantum magnetik dan nomor kuantum putaran itu Jumlah kuantum magnetik berguna dalam membedakan orbital yang tersedia di dalam subsklells, sedangkan angka spin kuantum menggambarkan energi, bentuk, dan orientasi orbital.
Angka kuantum adalah seperangkat nilai yang menggambarkan keadaan kuantum unik dari suatu elektron dalam sebuah atom. Ada empat angka kuantum spesifik: Angka kuantum utama, angka kuantum sudut, angka kuantum magnetik dan angka kuantum putaran.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu bilangan kuantum magnetik
3. Apa itu nomor spin kuantum
4. Perbandingan berdampingan -Angka kuantum magnetik vs nomor kuantum putaran dalam bentuk tabel
5. Ringkasan
Apa itu bilangan kuantum magnetik?
Nomor kuantum magnetik membedakan orbital yang tersedia di dalam subshells. Simbol untuk nilai ini adalah mSaya. Menurut definisinya, angka kuantum ini menyatakan bahwa elektron di setiap subshell tertentu memiliki angka kuantum sudut yang berkisar dari -l hingga +l plus nol. Oleh karena itu, subshells S, P, D dan F mengandung jumlah orbital yang berbeda. Tabel berikut menunjukkan jumlah orbital yang ada di setiap subshell.
| Subsksklell | Nilai untuk angka kuantum magnetik | Jumlah orbital |
| S | MSaya= 0 | 1 |
| P | MSaya= -1,0,+1 | 3 |
| D | MSaya= -2, -1,0,+1,+2 | 5 |
| F | MSaya= -3, -2, -1,0,+1,+2,+3 | 7 |
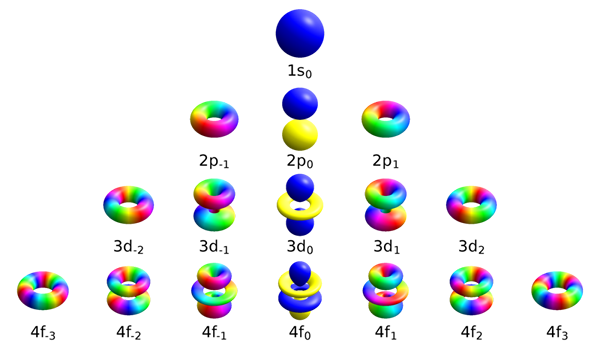
Jumlah kuantum magnetik menentukan pergeseran energi orbital yang terjadi karena medan magnet yang diterapkan secara eksternal. Kami menyebut efek ini sebagai "Efek Zeeman". Momen magnetik yang sebenarnya muncul dari dua faktor: momen sudut elektron dan spin elektron, yang dijelaskan dari bilangan kuantum magnetik.
Apa itu nomor spin kuantum?
Nomor spin kuantum menggambarkan energi, bentuk, dan orientasi orbital. Simbol untuk nilai ini adalah "S". Nomor kuantum putaran adalah parameter momentum sudut intrinsik dari sebuah atom. Momentum sudut putaran elektron dalam orbital diberikan sebagai s = 1/2.
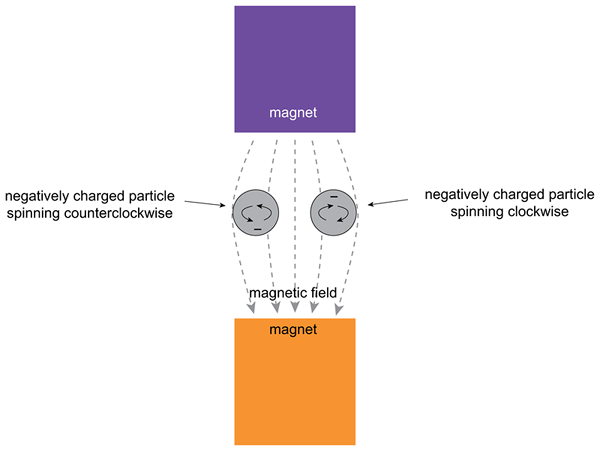
Gambar 02: Pengaruh medan magnet eksternal pada elektron
Orbital dapat berisi sepasang elektron; Oleh karena itu, kedua elektron memiliki s = -1/2 dan s =+1/2 angka kuantum putar. Ini mengacu pada orientasi elektron "spin-up" dan "spin-down". Angka kuantum menentukan keadaan kuantum elektron tertentu dari sebuah atom. Selain itu, kita dapat memberikan "jumlah total kuantum spin", yang memasangkan putaran beberapa elektron yang tidak berpasangan dari beberapa atom tertentu.
Apa perbedaan antara angka kuantum magnetik dan angka kuantum putaran?
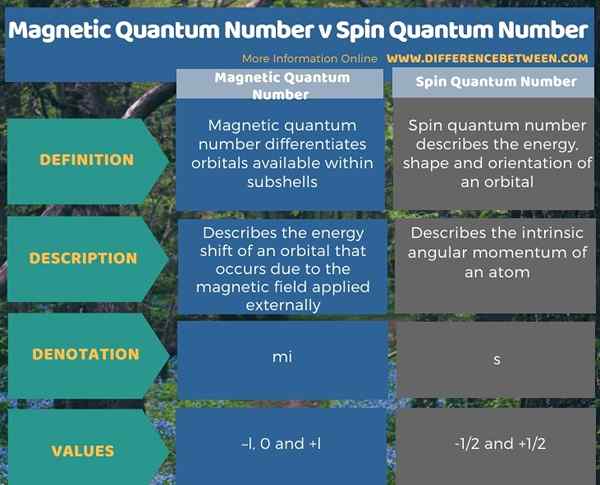
Angka kuantum adalah seperangkat nilai yang menggambarkan keadaan kuantum unik dari suatu elektron dalam sebuah atom. Perbedaan utama antara angka kuantum magnetik dan angka kuantum putaran adalah bahwa angka kuantum magnetik berguna dalam membedakan orbital yang tersedia di dalam subshells, sedangkan angka spin kuantum menggambarkan energi, bentuk, dan orientasi orbital. Nilai untuk angka kuantum magnetik diberikan sebagai -l, 0 dan +l. Simbol untuk nilai ini adalah mSaya. Tapi, nomor kuantum putaran diberikan sebagai -1/2 dan +1/2. Simbol untuk nilai ini adalah "S".
Selain itu, perbedaan lebih lanjut antara angka kuantum magnetik dan angka kuantum putaran adalah bahwa angka kuantum magnetik menggambarkan pergeseran energi orbital yang terjadi karena medan magnet yang diterapkan secara eksternal, sedangkan angka kuantum putaran menggambarkan momentum sudut intrinsik dari suatu atom.
Ringkasan -Angka kuantum magnetik vs nomor kuantum spin
Angka kuantum adalah seperangkat nilai yang menggambarkan keadaan kuantum unik dari suatu elektron dalam sebuah atom. Perbedaan utama antara angka kuantum magnetik dan angka kuantum putaran adalah bahwa angka kuantum magnetik berguna dalam membedakan orbital yang tersedia di dalam subshells, sedangkan angka spin kuantum menggambarkan energi, bentuk, dan orientasi orbital.
Referensi:
1. “Angka kuantum untuk atom.”Libretexts Chemistry, Libretexts, 27 September. 2019, tersedia di sini.
2. “Angka kuantum magnetik.”Wikipedia, Wikimedia Foundation, 16 Nov. 2019, tersedia di sini.
3. “Putar nomor kuantum.”Wikipedia, Wikimedia Foundation, 1 September. 2019, tersedia di sini.
4. Helmenstine, Anne Marie. “Definisi Nomor Kuantum Putar."Thoughtco, dec. 7, 2018, tersedia di sini.
Gambar milik:
1. “Atomik Orbital SPDF M -EigenStates” oleh Geek3 - karya sendiri, dibuat dengan hidrogen 1.1 (cc by-sa 4.0) Via Commons Wikimedia
2. “Dua partikel bermuatan negatif berputar di medan magnet” oleh CK -12 Foundation - File: High School Chemistry.PDF, halaman 280 (CC BY-SA 3.0) Via Commons Wikimedia


