Perbedaan antara halogen dan halida

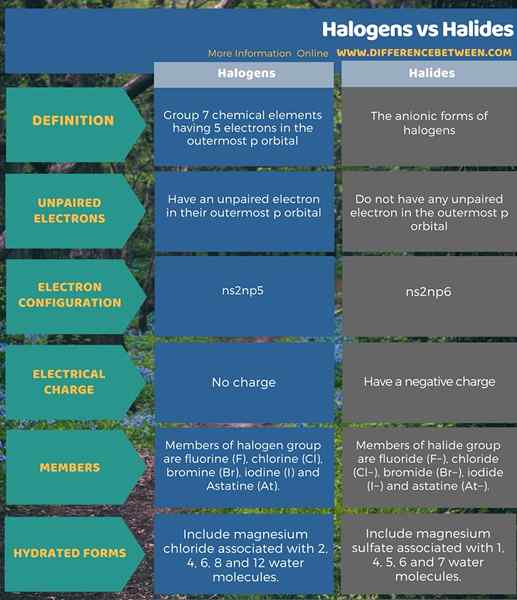
Itu perbedaan utama antara halogen dan halida adalah bahwa Halogen adalah elemen kimia yang memiliki satu elektron yang tidak berpasangan di orbital P terluar sedangkan halida tidak memiliki elektron yang tidak berpasangan.
Halogen adalah elemen Grup 7. Karena mereka memiliki elektron yang tidak berpasangan di orbital P, keadaan oksidasi halogen yang paling umum adalah -1 karena mereka bisa stabil dengan mendapatkan satu elektron. Elektron ini mendapatkan membentuk halida. Oleh karena itu, halida adalah bentuk anionik halogen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu halogen
3. Apa itu halides
4. Perbandingan berdampingan - halogen vs halida dalam bentuk tabel
5. Ringkasan
Apa itu halogen?
Halogen adalah elemen kimia kelompok 7 yang memiliki 5 elektron di orbital P terluar. Selain itu, elemen -elemen ini memiliki satu elektron yang tidak berpasangan di orbital P terluar. Oleh karena itu, sangat reaktif untuk mendapatkan elektron dari luar dan menjadi stabil. Mereka dengan mudah membentuk bentuk anionik, halida, dengan mendapatkan satu elektron.

Gambar 01: Penampilan halogen. (Dari kiri ke kanan: klorin, bromin, yodium.)
Anggota kelompok ini adalah fluor (F), klorin (CL), bromin (BR), yodium (I) dan astatine (AT). Selain itu, alasan memberi mereka nama halogen adalah bahwa mereka semua dapat membentuk garam natrium dengan sifat yang sama. Kita dapat melihat semua fase materi dalam kelompok ini; Fluor dan klorin adalah gas di alam, bromin adalah cairan dan yodium adalah senyawa padat dalam kondisi normal. Astatine adalah elemen radioaktif. Selain itu, konfigurasi elektron umum dari elemen -elemen ini adalah NS2np5.
Apa itu halides?
Halida adalah bentuk anionik halogen. Oleh karena itu, spesies kimia ini terbentuk ketika halogen mendapatkan elektron dari luar untuk mendapatkan konfigurasi elektron yang stabil. Kemudian konfigurasi elektron menjadi NS2np6. Namun, halida akan selalu memiliki muatan negatif. Anggota kelompok ini termasuk fluoride (f-), klorida (CL-), bromida (BR-), iodide (i-) dan astatine (at-). Garam yang memiliki ion ini adalah garam halida. Selain itu, semua halida ini tidak berwarna dan terjadi pada senyawa kristal padat. Padatan ini memiliki entalpi pembentukan negatif yang tinggi. Oleh karena itu, ini berarti padatan ini dengan mudah terbentuk.
Ada tes khusus dari mana kami dapat mengidentifikasi keberadaan halida. Misalnya, kita dapat menggunakan nitrat perak untuk menunjukkan keberadaan klorida, bromida, dan iodida. Itu karena, ketika kita menambahkan nitrat perak ke dalam larutan yang mengandung ion klorida, endapan perak klorida. Jika kita menambahkan nitrat perak ke larutan yang mengandung bromida, bentuk endapan bromida perak krim. Untuk ion iodida yang mengandung solusi, ini memberikan endapan berwarna hijau. Tapi, kami tidak dapat mengidentifikasi fluoride dari tes ini karena fluorida tidak dapat membentuk endapan dengan nitrat perak.
Apa perbedaan antara halogen dan halida?
Halogen adalah elemen kimia grup 7 yang memiliki 5 elektron di orbital P terluar, termasuk elektron yang tidak berpasangan. Halida adalah bentuk anionik halogen dan tidak memiliki elektron yang tidak berpasangan. Ini adalah perbedaan utama antara halogen dan halida. Selanjutnya, anggota kelompok halogen adalah fluor (F), klorin (CL), bromin (BR), yodium (I) dan astatin (AT). Di sisi lain, anggota kelompok halida adalah fluoride (f-), klorida (CL-), bromida (BR-), iodide (i-) dan astatine (at-). Diberikan di bawah ini adalah perbedaan terperinci antara halogen dan halida dalam bentuk tabel.
Ringkasan -Halogen vs halida
Halogen adalah elemen grup 7 yang memiliki elektron yang tidak berpasangan di orbital luar. Mereka membentuk halida dengan mendapatkan elektron dan menjadi stabil. Oleh karena itu, perbedaan utama antara halogen dan halida adalah bahwa halogen adalah elemen kimia yang memiliki satu elektron yang tidak berpasangan di orbital P terluar sedangkan halida tidak memiliki elektron yang tidak berpasangan.
Referensi:
1. “Halide.”Wikipedia, Wikimedia Foundation, 27 Juni 2018. Tersedia disini
2. Christe, Karl, dkk. “Elemen halogen.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 Nov. 2017. Tersedia disini
Gambar milik:
1.'Halogens'by w. Oelen - Science Made Alive: Chemistry, (CC BY -SA 3.0) Via Commons Wikimedia


