Perbedaan antara panas pembentukan dan panas reaksi
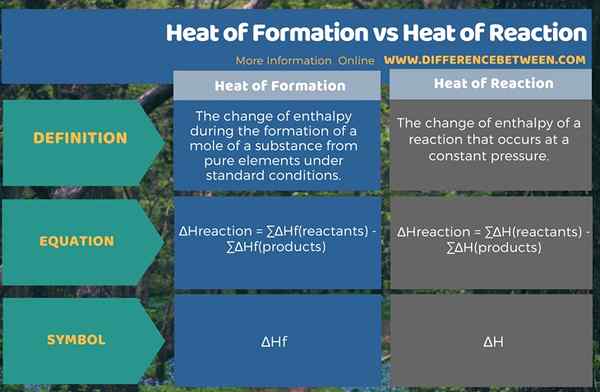
Itu perbedaan utama antara panas pembentukan dan panas reaksi adalah bahwa Panas pembentukan adalah perubahan entalpi selama pembentukan mol zat pada kondisi standar sedangkan panas reaksi adalah perubahan entalpi selama reaksi kimia yang terjadi pada tekanan konstan.
Panas pembentukan dan panas reaksi adalah nilai entalpi penting mengenai reaksi kimia. Kami mendefinisikan istilah -istilah ini untuk kondisi standar, i.e. Tekanan standar dan suhu standar. Di sini, panas atau entalpi adalah energi yang dilepaskan dari suatu sistem atau diserap oleh suatu sistem selama reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu panas formasi
3. Apa panas reaksi
4. Perbandingan berdampingan - panas formasi vs panas reaksi dalam bentuk tabel
5. Ringkasan
Apa itu panas formasi?
Panas formasi adalah perubahan entalpi selama pembentukan mol zat dari unsur -unsur murni dalam kondisi standar. Di sini, kondisi standarnya adalah tekanan 1 atm dan 298.15 Suhu Kelvin. Karena kami mempertimbangkan pembentukan satu tahi lalat, unit untuk energi ini adalah KJ/mol. Energi ini adalah energi yang dilepaskan oleh reaksi pembentukan atau energi yang dikonsumsi reaksi selama perkembangan. Persamaan entalpi ini adalah sebagai berikut;

Di sini, ∆ adalah simbol, yang menunjukkan perubahan entalpi, h adalah jumlah energi dan f menunjukkan reaksi formasi. Dalam reaksi ini, semua konstituen berada dalam kondisi standar, jika tidak, itu bukan panas pembentukan. Misalnya, pembentukan karbon dioksida adalah sebagai berikut.
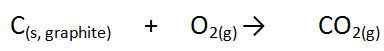
Bentuk unsur karbon murni adalah grafit dan sumber oksigen adalah molekul oksigen diatomik. Ketika kami melakukan reaksi formasi ini dalam kondisi standar dan mengukur perubahan entalpi, kami menyebutnya panas formasi.
Apa panas reaksi?
Panas reaksi adalah perubahan entalpi reaksi yang terjadi pada tekanan konstan. Kami mengukur perbedaan energi ini dalam unit kJ/mol. Ini memberikan energi yang dilepaskan atau diserap selama reaksi kimia. Simbol untuk perubahan entalpi ini adalah ∆H. Jika nilainya adalah nilai positif, kami menyebutnya reaksi endotermik. Jika nilainya negatif, kami menyebutnya reaksi eksotermik. Persamaan untuk perubahan entalpi ini adalah sebagai berikut;
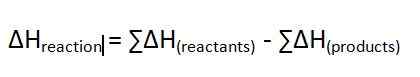
Apa perbedaan antara panas pembentukan dan panas reaksi?
Panas formasi adalah perubahan entalpi selama pembentukan mol zat dari unsur -unsur murni dalam kondisi standar. Simbol untuk perubahan entalpi ini adalah, ∆HF. Panas reaksi adalah perubahan entalpi reaksi yang terjadi pada tekanan konstan. Simbol untuk perubahan entalpi ini adalah, ∆H.

Ringkasan -Panas Formasi vs Panas Reaksi
Enthalpy adalah kandungan energi. Perubahan entalpi menunjukkan berapa banyak pertukaran energi antara reaktan, produk dan sekitarnya. Perbedaan antara panas pembentukan dan panas reaksi adalah bahwa panas pembentukan adalah perubahan entalpi selama pembentukan mol zat pada kondisi standar sedangkan panas reaksi adalah perubahan entalpi selama reaksi kimia yang terjadi pada tekanan konstan.
Referensi:
1. Libretexts. “Entalpi pembentukan standar."Kimia Libretexts, Libretexts, 9 Feb. 2017. Tersedia disini
2. Britannica, editor Encyclopaedia. “Panas reaksi.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4 Apr. 2016. Tersedia disini


