Perbedaan antara energi disosiasi ikatan homolitik dan heterolitik
Perbedaan utama - Energi disosiasi ikatan heterolitik vs
Energi disosiasi ikatan adalah ukuran kekuatan ikatan kimia. Ikatan dapat dipisahkan dengan cara homolitik atau heterolitik. Energi disosiasi ikatan didefinisikan sebagai perubahan entalpi standar ketika ikatan kimia dibelah melalui homolisis. Energi Disosiasi Ikatan Homolitik adalah jumlah energi yang dibutuhkan untuk memisahkan ikatan kimia melalui hemolisis sedangkan energi disosiasi ikatan heterolitik adalah jumlah energi yang dibutuhkan untuk menutup ikatan kimia melalui heterolisis. Nilai energi disosiasi ikatan homolitik berbeda dari energi disosiasi ikatan heterolitik untuk senyawa yang sama. Ini adalah perbedaan utama antara energi disosiasi ikatan homolitik dan heterolitik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi disosiasi ikatan homolitik
3. Apa itu energi disosiasi ikatan heterolitik
4. Perbandingan berdampingan - energi disosiasi ikatan heterolitik vs heterolitik dalam bentuk tabel
5. Ringkasan
Apa itu energi disosiasi ikatan homolitik?
Energi disosiasi ikatan homolitik adalah jumlah energi yang dibutuhkan untuk memisahkan ikatan kimia melalui hemolisis. Hemolisis ikatan kimia adalah pembelahan simetris dari ikatan yang membentuk dua radikal, bukan dua ion. Di sini, elektron ikatan antara atom dibagi menjadi dua bagian dan diambil oleh dua atom. Misalnya, pembelahan homolitik dari ikatan sigma membentuk dua radikal yang memiliki satu elektron tidak berpasangan per masing -masing radikal.

Gambar 1: Homolisis
Energi disosiasi ikatan didefinisikan sebagai jumlah energi yang dibutuhkan untuk memecah ikatan kimia melalui hemolisis pada kondisi standar. Energi disosiasi ikatan homolitik menentukan apakah ikatan kimia kuat atau lemah. Jika nilai energi disosiasi ikatan homolitik lebih tinggi, ini menunjukkan bahwa jumlah energi yang tinggi harus disediakan untuk membelah ikatan itu; Oleh karena itu, ini adalah ikatan yang kuat.
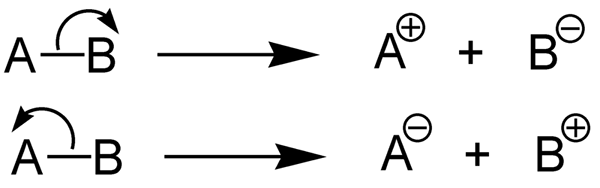
Apa itu energi disosiasi ikatan heterolitik?
Energi Disosiasi Ikatan Heterolitik adalah jumlah energi yang dibutuhkan untuk menutup ikatan kimia melalui heterolisis. Heterolisis adalah pembelahan ikatan kimia dengan cara asimetris. Heterolisis membentuk kation dan anion. Ini karena, dalam heterolisis, pasangan elektron ikatan diambil oleh atom elektronegatif (dikonversi menjadi anion) sedangkan atom lainnya tidak mengambil elektron (itu membentuk kation).

Gambar 2: Heterolisis ikatan kimia
Jika dibandingkan dengan homolisis molekul, heterolisis molekul yang sama adalah nilai yang berbeda dari homolisis. Ini berarti energi disosiasi ikatan homolitik dari suatu senyawa berbeda dari energi disosiasi ikatan heterolitik dari molekul yang sama.
Contoh: Mari kita pertimbangkan pembelahan ikatan H-H dalam molekul hidrogen.
Disosiasi ikatan homolitik: h2 → H ● +H ● (Energi disosiasi ikatan adalah 104 kkal/mol)
Disosiasi ikatan heterolitik: h2 → H+ + H- (Energi disosiasi ikatan adalah 66 kkal/mol)
Apa perbedaan antara energi disosiasi ikatan homolitik dan heterolitik?
Energi disosiasi ikatan heterolitik vs | |
| Energi disosiasi ikatan homolitik adalah jumlah energi yang dibutuhkan untuk memisahkan ikatan kimia melalui hemolisis. | Energi Disosiasi Ikatan Heterolitik adalah jumlah energi yang dibutuhkan untuk menutup ikatan kimia melalui heterolisis. |
| Produk | |
| Energi disosiasi ikatan homolitik dikaitkan dengan pembentukan radikal dengan pembelahan ikatan kimia. | Energi disosiasi ikatan heterolitik dikaitkan dengan pembentukan kation dan anion dengan pembelahan ikatan kimia. |
Ringkasan -Energi disosiasi ikatan heterolitik vs
Energi disosiasi ikatan adalah energi yang diperlukan untuk memecah ikatan kimia melalui homolisis pada kondisi standar. Ada dua jenis pembelahan ikatan sebagai homolisis dan heterolisis. Pembelahan ikatan homolitik membentuk radikal sedangkan pembelahan ikatan heterolitik membentuk kation dan anion. Perbedaan utama antara energi disosiasi ikatan homolitik dan heterolitik adalah bahwa nilai energi disosiasi ikatan homolitik berbeda dari energi disosiasi ikatan heterolitik untuk senyawa yang sama.
Referensi:
1. “Energi Disosiasi Obligasi.”Wikipedia, Wikimedia Foundation, 28 Feb. 2018, tersedia di sini.
2. “Heterolisis (Kimia).”Wikipedia, Wikimedia Foundation, 19 Feb. 2018, tersedia di sini.
3. “Energi disosiasi ikatan = pembelahan homolitik.”Master Organic Chemistry RSS, tersedia di sini.
Gambar milik:
1. “Homolisis (Kimia)” oleh Jürgen Martens - Jürgen Martens (domain publik) melalui Commons Wikimedia
2. “Heterolisis (Kimia)” oleh [Jürgen Martens - Jürgen Martens (CC BY -SA 3.0) Via Commons Wikimedia


