Perbedaan antara asam hidrofluorik dan asam klorida

Itu perbedaan utama antara asam hidrofluorat dan asam klorida adalah bahwa Asam hidrofluorat adalah asam lemah sedangkan asam hidroklorat adalah asam yang kuat. Juga, asam hidrofluorat mampu membentuk ikatan hidrogen sedangkan asam klorida tidak dapat membentuk ikatan hidrogen.
Selain itu, satu perbedaan penting lainnya antara asam hidrofluorat dan asam klorida adalah dalam struktur molekulnya. Itu Molekul asam hidrofluorat memiliki ion fluorida sedangkan molekul asam hidroklorat memiliki ion klorida. Selanjutnya, baik asam hidrofluorik dan hidroklorat adalah donor proton. Oleh karena itu, molekul asam ini dapat terionisasi dalam media berair melepaskan proton (H+). Proton ini menyebabkan keasaman dalam media berair.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam hidrofluorik
3. Apa itu asam klorida
4. Perbandingan berdampingan - asam hidrofluorat vs asam klorida dalam bentuk tabel
5. Ringkasan
Apa itu asam hidrofluorik?
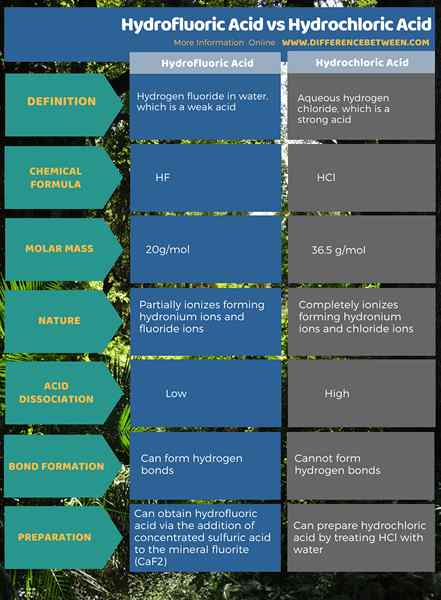
Asam hidrofluorat adalah hidrogen fluorida dalam air. Hidrogen fluorida adalah senyawa asam yang memiliki formula kimia HF dan massa molar 20 g/mol. Selanjutnya, asam ini adalah senyawa awal untuk hampir semua senyawa yang mengandung fluorin. Mis: Teflon. Asam ini sangat reaktif dengan kaca dan cukup reaktif dengan logam. Oleh karena itu, disimpan dalam wadah plastik. Namun, wadah yang terbuat dari Teflon sedikit permeabel terhadap asam ini.

Gambar 01: sebotol asam hidrofluorik
Asam hidrofluorat adalah asam lemah. Itu karena memiliki konstanta disosiasi yang lebih rendah. Disosiasi asam ini menghasilkan ion hidronium (kombinasi proton dan molekul air membentuk ion hidronium) dan ion fluorida. Di antara asam hidrohalic, ini adalah satu -satunya asam lemah. Kami dapat memperoleh asam ini melalui penambahan asam sulfat pekat ke fluorit mineral (CAF2).
Apa itu asam klorida?
Asam klorida adalah hidrogen klorida berair. Hidrogen klorida memiliki formula kimia HCl, dan massa molarnya 36.5 g/mol. Asam ini memiliki bau yang pedas. Selain itu, penting sebagai senyawa awal bagi banyak bahan kimia anorganik seperti vinil klorida.

Gambar 02: sebotol asam klorida
Tidak seperti HF, HCL adalah asam kuat yang dapat sepenuhnya terionisasi dalam media berair, membentuk ion hidronium dan ion klorida. Dengan demikian, asam ini memiliki nilai KA yang tinggi. Kita dapat menyiapkan asam ini dengan mengolah HCl dengan air.
Apa perbedaan antara asam hidrofluorik dan asam klorida?
Asam hidrofluorat adalah hidrogen fluorida dalam air. Itu adalah asam lemah, dan dapat membentuk ikatan hidrogen. Asam klorida hidroklorat adalah hidrogen klorida berair. Itu adalah asam yang kuat, dan tidak dapat membentuk ikatan hidrogen. Ini adalah perbedaan utama antara asam hidrofluorik dan asam klorida.
Selanjutnya, molekul asam hidrofluorat memiliki ion fluorida sedangkan molekul asam hidroklorat memiliki ion klorida. Namun, keduanya adalah asam hidrohalic yang memiliki atom hidrogen yang terikat pada halogen. Selain itu, asam hidrofluorat adalah satu -satunya asam lemah di antara asam hidrohalic lainnya.
Ringkasan -Asam Hydrofluoric vs asam klorida
Asam hidrofluorik dan hidroklorat adalah asam hidrohalic karena kedua senyawa asam ini memiliki halida yang terikat pada atom hidrogen. Selain itu, ada banyak perbedaan antara kedua asam ini. Perbedaan antara asam hidrofluorat dan asam hidroklorat adalah bahwa asam hidrofluorat adalah asam lemah dan dapat membentuk ikatan hidrogen sedangkan asam hidroklorat adalah asam yang kuat dan tidak mampu membentuk ikatan hidrogen.
Referensi:
1. “Asam Hydrofluoric."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
2. "Asam hidroklorik."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
Gambar milik:
1.'Hydrogen Fluoride'by User: Dorgan-Self-Fotographed, (CC BY-SA 3.0) Via Commons Wikimedia
2.'Asam Hidroklorat 05' (Domain Publik) Via Commons Wikimedia


