Perbedaan antara ikatan ionik dan kovalen
Itu perbedaan utama Antara ikatan ionik dan kovalen adalah itu Ikatan ionik terjadi antara atom yang memiliki elektronegatif yang sangat berbeda sedangkan ikatan kovalen terjadi antara atom dengan perbedaan elektronegativitas yang sama atau sangat rendah.
Seperti yang diusulkan oleh ahli kimia Amerika G.N.Lewis mengusulkan agar atom stabil ketika mengandung delapan elektron di cangkang valensi mereka. Sebagian besar atom memiliki kurang dari delapan elektron dalam cangkang valensi mereka (kecuali gas mulia dalam kelompok 18 dari tabel periodik); Oleh karena itu, mereka tidak stabil. Atom -atom ini cenderung bereaksi satu sama lain menjadi stabil. Dengan demikian, setiap atom dapat mencapai konfigurasi elektronik gas mulia. Ikatan ionik dan kovalen adalah dua jenis utama ikatan kimia, yang menghubungkan atom dalam senyawa kimia.

ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ikatan ionik
3. Whare adalah ikatan kovalen
4. Perbandingan berdampingan - ikatan kovalen ionik vs dalam bentuk tabel
5. Ringkasan
Apa itu ikatan ionik?
Atom dapat memperoleh atau kehilangan elektron dan membentuk partikel bermuatan negatif atau positif; yang kami sebut ion. Ada interaksi elektrostatik antara ion. Ikatan ionik adalah kekuatan yang menarik antara ion yang bermuatan berlawanan ini. Elektronegatifitas atom dalam ikatan ionik sebagian besar mempengaruhi kekuatan interaksi elektrostatik antara ion.

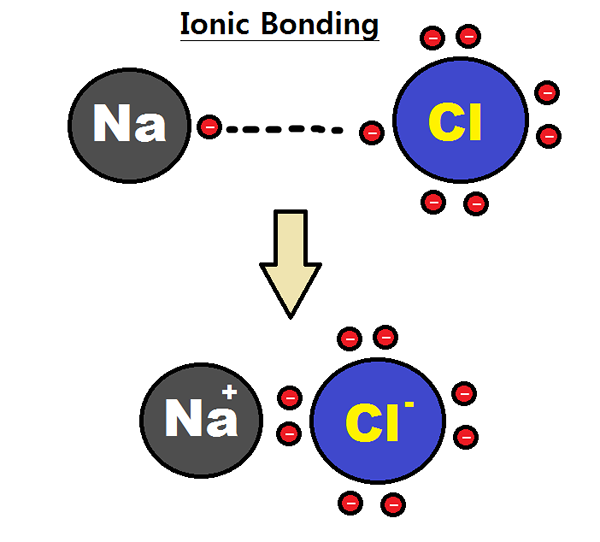
Gambar 01: Pembentukan ikatan ionik antara atom natrium dan klorin
Elektronegativitas adalah pengukuran afinitas atom terhadap elektron. Atom, dengan elektronegativitas tinggi dapat menarik elektron dari atom dengan elektronegativitas rendah untuk membentuk ikatan ionik. Misalnya, natrium klorida memiliki ikatan ionik antara ion natrium dan ion klorida. Sodium adalah logam dan klorin adalah non -logam; Oleh karena itu, ia memiliki elektronegativitas yang sangat rendah (0.9) dibandingkan dengan klorin (3.0). Karena perbedaan elektronegativitas ini, klorin dapat menarik elektron dari natrium dan membentuk CL-. Pada saat yang sama, natrium membentuk na+ ion. Karena itu, kedua atom mendapatkan konfigurasi elektronik gas mulia yang stabil. Cl- dan na+ disatukan oleh gaya elektrostatik yang menarik, sehingga membentuk ikatan ionik; NA-Cl Bond.
Apa itu obligasi kovalen?
Saat dua atom, memiliki perbedaan elektronegativitas yang serupa atau sangat rendah, bereaksi bersama, mereka membentuk ikatan kovalen dengan berbagi elektron. Dengan cara ini, kedua atom dapat memperoleh konfigurasi elektronik gas mulia dengan berbagi elektron. Molekul adalah produk yang dihasilkan dari pembentukan ikatan kovalen antara atom. Misalnya, atom dari elemen yang sama bergabung untuk membentuk molekul seperti CL2, H2, atau p4, Setiap atom berikatan dengan yang lain melalui ikatan kovalen.
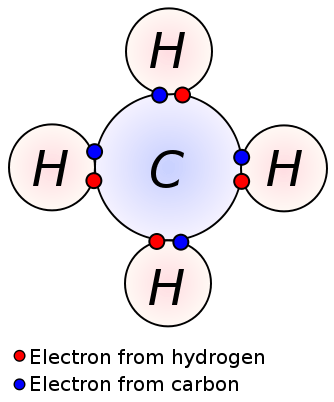
Gambar 02: Ikatan kovalen antara atom karbon dan hidrogen dalam molekul metana
Molekul metana (ch4) juga memiliki ikatan kovalen antara atom karbon dan hidrogen; Ada empat ikatan kovalen antara satu atom karbon sentral dan empat atom hidrogen (empat ikatan C-H). Metana adalah contoh molekul yang memiliki ikatan kovalen antara atom dengan perbedaan elektronegativitas yang sangat rendah.
Apa perbedaan antara ikatan ionik dan kovalen?
Ikatan ionik vs kovalen | |
| Hubungan kimia antara dua atom yang disebabkan oleh gaya elektrostatik antara ion bermuatan berlawanan dalam senyawa ionik. | Hubungan kimia antara dua atom atau ion di mana pasangan elektron dibagi di antara mereka. |
| Jumlah atom | |
| Terjadi antara logam dan bukan logam. | Paling sering terjadi antara dua non -logam. |
| Jumlah elektron | |
| Transfer elektron yang lengkap terjadi. | Terjadi ketika dua (atau lebih) elemen berbagi elektron. |
| Senyawa | |
| Biasanya dipandang sebagai kristal, di mana beberapa ion bermuatan positif mengelilingi ion bermuatan negatif. | Atom yang diikat oleh ikatan kovalen ada sebagai molekul, yang pada suhu kamar, terutama ada sebagai gas atau cairan. |
| Polaritas | |
| Obligasi ionik memiliki polaritas yang tinggi. | Obligasi kovalen memiliki polaritas yang rendah. |
| Properti fisik | |
| Senyawa ionik memiliki titik leleh yang sangat tinggi dan titik didih, dibandingkan dengan molekul kovalen. | Molekul kovalen memiliki titik leleh yang rendah dan titik didih dibandingkan dengan senyawa ionik. |
| Kelarutan air | |
| Dalam pelarut kutub (seperti air), senyawa ionik melarutkan ion pelepasan; Solusi semacam itu mampu menghantarkan listrik. | Dalam pelarut kutub, molekul kovalen tidak banyak larut; Karenanya solusi ini tidak mampu menghantarkan listrik. |
Ringkasan -Ionic vs Covalent Bonds
Ikatan ionik dan kovalen adalah dua jenis ikatan kimia utama yang ada dalam senyawa. Perbedaan antara ikatan ionik dan kovalen adalah bahwa ikatan ionik terjadi antara atom yang memiliki elektronegatif yang sangat berbeda sedangkan ikatan kovalen terjadi antara atom dengan perbedaan elektronegativitas yang sama atau sangat rendah.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Definisi ikatan ionik."Thoughtco, Feb. 10, 2017. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Definisi ikatan kovalen."Thoughtco, Feb. 7, 2018. Tersedia disini
Gambar milik:
1.'Ionicbondingrh11'by rhannosh - karya sendiri, (cc by -sa 3.0) Via Commons Wikimedia
2.'Covalent'by Dynablast - Dibuat dengan Inkscape, (CC BY -SA 2.5) Via Commons Wikimedia


