Perbedaan antara senyawa ionik dan molekul
Itu perbedaan utama Antara senyawa ionik dan molekul adalah bahwa Senyawa ionik memiliki gaya tarik elektrostatik antara kation dan anion sedangkan senyawa molekul hanya memiliki ikatan kimia kovalen antara atom.
Unsur kimia dapat bergabung satu sama lain untuk membentuk senyawa kimia. Elemen -elemen tersebut mengikat bersama melalui ikatan kimia yang memiliki karakteristik ionik atau kovalen. Jika senyawa memiliki ikatan ionik, kami menyebutnya sebagai senyawa ionik, dan jika mereka memiliki ikatan kovalen, maka mereka adalah senyawa molekuler. Oleh karena itu, perbedaan utama antara senyawa ionik dan molekul terletak pada ikatan kimia antara atom.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Whare adalah senyawa ionik
3. Apa itu senyawa molekul
4. Perbandingan berdampingan - Senyawa molekul ionik vs dalam bentuk tabel
5. Ringkasan
Apa itu senyawa ionik?
Senyawa ionik adalah senyawa kimia yang memiliki kation dan anion yang mengikat satu sama lain melalui ikatan ionik. Oleh karena itu, ada gaya tarik elektrostatik antara kation dan anion. Namun, senyawa tersebut memiliki muatan netral secara keseluruhan karena muatan total kation dinetralkan dengan muatan total anion. Ion -ion ini bisa berupa monoatomik atau politisomik.
Biasanya, senyawa ionik yang mengandung ion hidrogen (h+) karena kation adalah "asam". Sebaliknya, ion dasar seperti ion hidroksida (oh-) hadir di pangkalan. Jika tidak ada ion hidrogen atau ion hidroksida dalam senyawa ionik, maka kami sebut sebagai "garam".

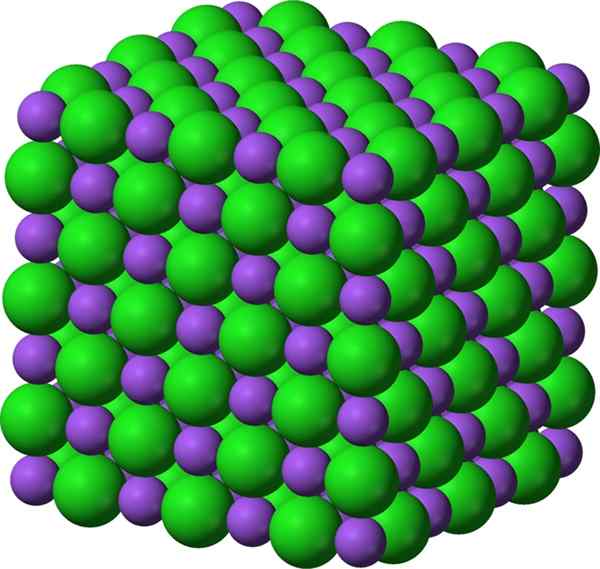
Gambar 01: Senyawa ionik natrium klorida, yang merupakan garam
Beberapa senyawa ionik seperti garam terbentuk dari reaksi netralisasi asam-basa. Beberapa senyawa terbentuk melalui penguapan pelarut, reaksi curah hujan, reaksi solid-state, pembekuan, reaksi transfer elektron antara logam dan non-logam, dll. Biasanya, senyawa ini memiliki titik leleh dan mendidih yang tinggi. Sebagian besar waktu mereka keras dan rapuh. Dalam keadaan padat mereka, hampir semua senyawa ionik adalah isolator listrik, dan mereka dapat menjadi sangat konduktif ketika dilarutkan dalam pelarut seperti air karena kation dan anion dapat bergerak dengan bebas.
Apa itu senyawa molekul?
Senyawa molekuler adalah senyawa kimia yang mengandung atom yang terikat satu sama lain melalui ikatan kimia kovalen. Oleh karena itu, senyawa ini terbentuk ketika atom berbagi elektron yang tidak berpasangan satu sama lain. Atom -atom yang terlibat dalam berbagi elektron ini memiliki nilai elektronegativitas yang serupa.
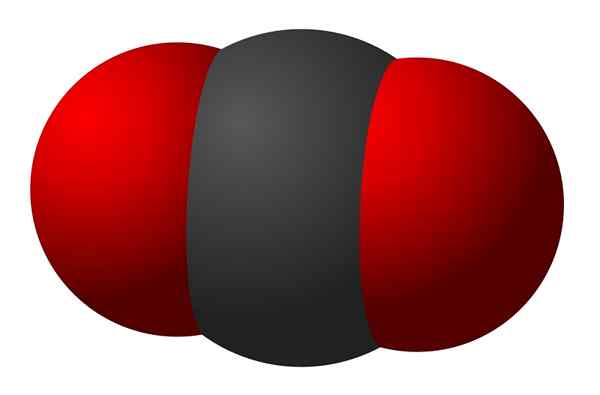
Gambar 02: Diagram molekul triatomik yang memiliki ikatan kovalen antara ketiga atom
Biasanya, senyawa molekul memiliki titik leleh dan mendidih yang relatif rendah karena atom tidak terlalu melekat satu sama lain. Demikian pula, senyawa ini lembut dan relatif fleksibel. Dibandingkan dengan senyawa ionik, senyawa molekul ini sangat mudah terbakar. Ini karena hampir semua zat yang mudah terbakar adalah senyawa molekul yang terdiri dari atom karbon dan hidrogen. Tidak seperti senyawa ionik, mereka tidak dapat menghantarkan listrik saat dilarutkan dalam pelarut karena tidak ada ion yang tersedia untuk dipisahkan setelah larut.
Apa perbedaan antara senyawa ionik dan molekul?
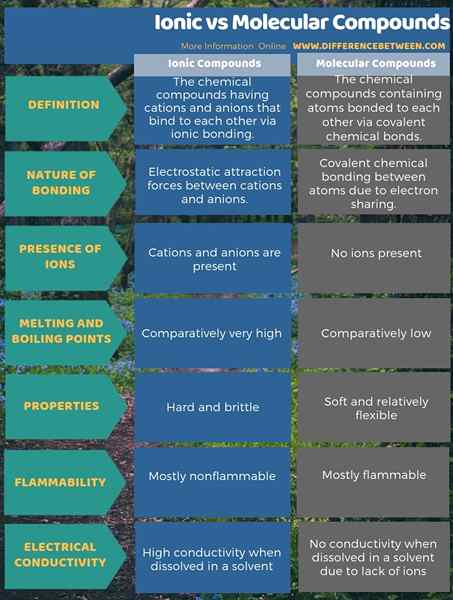
Senyawa ionik adalah senyawa kimia yang memiliki kation dan anion yang berikatan satu sama lain melalui ikatan ionik sedangkan senyawa molekul adalah senyawa kimia yang mengandung atom yang terikat satu sama lain melalui ikatan kimia kovalen kovalen. Oleh karena itu, perbedaan antara senyawa ionik dan molekul terletak pada sifat ikatan kimia. Itu adalah; Perbedaan utama antara senyawa ionik dan molekul adalah bahwa senyawa ionik memiliki gaya tarik elektrostatik antara kation dan anion sedangkan senyawa molekul hanya memiliki ikatan kimia kovalen antara atom.
Sebagai perbedaan penting lainnya antara senyawa ionik dan molekul, senyawa ionik keras dan rapuh sementara senyawa molekul lembut dan relatif fleksibel. Ini terutama karena atom -atom senyawa ionik dipegang secara rapat oleh ikatan ionik sedangkan pada senyawa molekul atom yang saling menempel secara relatif longgar. Selain itu, titik peleburan dan didih dari senyawa ionik sangat tinggi dibandingkan dengan senyawa molekul.
Ringkasan -Senyawa Ionik Vs Molekul
Senyawa ionik memiliki ikatan ionik sedangkan senyawa molekul memiliki ikatan kovalen. Oleh karena itu, perbedaan utama antara senyawa ionik dan molekul adalah bahwa senyawa ionik memiliki gaya tarik elektrostatik antara kation dan anion sedangkan senyawa molekul hanya memiliki ikatan kimia kovalen antara atom.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Sifat senyawa kovalen atau molekul."Thoughtco, Jun. 7, 2018. Tersedia disini
2. “Senyawa ionik.”Wikipedia, Wikimedia Foundation, 20 Okt. 2018. Tersedia disini
Gambar milik:
1.”Sodium-Chloride-3d-ionic” oleh Benjah-BMM27-karya sendiri, (domain publik) via Commons Wikimedia
2.”Carbon-Dioxide-3D-VDW” oleh Jacek FH-Karya Sendiri (CC BY-SA 3.0) Via Commons Wikimedia


