Perbedaan antara isomer dan resonansi

Isomer vs Resonance | Struktur Resonansi vs Isomer | Isomer konstitusional, stereoisomer, enansiomer, diastereomer
Molekul atau ion yang memiliki formula molekul yang sama dapat ada dengan cara yang berbeda tergantung pada perintah ikatan, perbedaan distribusi muatan, cara mereka mengatur diri mereka sendiri dalam ruang dll.
Isomer
Isomer adalah senyawa yang berbeda dengan formula molekul yang sama. Ada berbagai jenis isomer. Isomer dapat dibagi menjadi dua kelompok sebagai isomer dan stereoisomer konstitusional. Isomer konstitusional adalah isomer di mana konektivitas atom berbeda dalam molekul. Butana adalah alkana paling sederhana untuk menunjukkan isomerisme konstitusional. Butana memiliki dua isomer konstitusional, butana itu sendiri dan isobutene.
Ch3Ch2Ch2Ch3 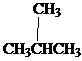
Butana isobutane/ 2-methylpropane
Dalam stereoisomer, atom terhubung dalam urutan yang sama, tidak seperti isomer konstitusional. Stereoisomer hanya berbeda dalam pengaturan atom mereka di luar angkasa. Stereoisomer dapat terdiri dari dua jenis, enansiomer dan diastereomer. Diastereomer adalah stereoisomer yang molekulnya tidak saling mencerminkan satu sama lain. Isomer trans cis 1, 2-dikloroetena adalah diastereomer. Enantiomer adalah stereoisomer yang molekulnya adalah gambar cermin yang tidak dapat diposisikan satu sama lain. Enantiomer hanya terjadi dengan molekul kiral. Molekul kiral didefinisikan sebagai yang tidak identik dengan gambar cerminnya. Oleh karena itu, molekul kiral dan gambar cerminnya adalah enansiomer satu sama lain. Misalnya, molekul 2-butanol adalah kiral, dan gambar cerminnya adalah enansiomer.
Resonansi
Saat menulis struktur Lewis, kami hanya menunjukkan elektron valensi. Dengan memiliki atom berbagi atau mentransfer elektron, kami mencoba memberikan setiap atom konfigurasi elektronik gas mulia. Namun, pada upaya ini, kami dapat memaksakan lokasi buatan pada elektron. Akibatnya, lebih dari satu struktur Lewis yang setara dapat ditulis untuk banyak molekul dan ion. Struktur yang ditulis dengan mengubah posisi elektron dikenal sebagai struktur resonansi. Ini adalah struktur yang hanya ada secara teori. Struktur resonansi menyatakan dua fakta tentang struktur resonansi.
- Tidak ada struktur resonansi yang akan menjadi representasi yang benar dari molekul yang sebenarnya; Tidak ada yang sepenuhnya akan menyerupai sifat kimia dan fisik dari molekul yang sebenarnya.
- Molekul aktual atau ion akan paling baik diwakili oleh hibrida dari semua struktur resonansi.
Struktur resonansi ditunjukkan dengan panah ↔. Berikut ini adalah struktur resonansi ion karbonat (CO32-).
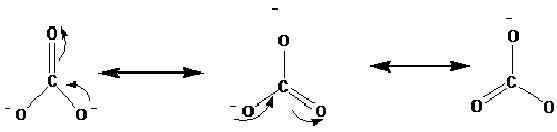
Studi x-ray telah menunjukkan bahwa molekul yang sebenarnya ada di antara resonansi ini. Menurut penelitian, semua ikatan karbon-oksigen memiliki panjang yang sama dalam ion karbonat. Namun, menurut struktur di atas kita dapat melihatnya adalah ikatan rangkap, dan dua adalah ikatan tunggal. Oleh karena itu, jika struktur resonansi ini terjadi secara terpisah, idealnya harus ada panjang ikatan yang berbeda dalam ion. Panjang ikatan yang sama menunjukkan bahwa tidak ada struktur ini yang benar -benar hadir di alam, lebih tepatnya hibrida dari ini ada.
| Apa perbedaan antara Isomer dan resonansi? • Dalam isomer, pengaturan atom atau susunan spasial molekul mungkin berbeda. Namun dalam struktur resonansi, faktor -faktor ini tidak berubah. Melainkan, mereka hanya memiliki perubahan posisi elektron. • Isomer secara alami hadir, tetapi struktur resonansi tidak ada dalam kenyataan. Mereka adalah struktur hipotetis, yang hanya dibatasi teori. |


