Perbedaan antara isotop dan isobar dan isoton
Perbedaan utama - Isotop vs Isobar vs isoton
Isotop adalah atom dari elemen kimia yang sama yang memiliki jumlah neutron yang berbeda. Oleh karena itu isotop dari elemen kimia yang sama memiliki jumlah atom yang sama tetapi massa atom yang berbeda. Isobar adalah atom dari berbagai elemen kimia. Oleh karena itu angka atom pada dasarnya berbeda satu sama lain. Isoton memiliki jumlah neutron yang sama dalam inti atomnya. Itu perbedaan utama Antara isotop, isobar dan isoton adalah itu Isotop adalah atom dengan jumlah proton yang sama, tetapi jumlah yang berbeda dari neutron dan isobar adalah atom dari elemen kimia yang berbeda yang memiliki nilai yang sama untuk massa atom sedangkan isoton adalah atom dari elemen kimia yang berbeda yang memiliki jumlah neutron yang sama dalam inti atomik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu isotop
3. Apa itu Isobar
4. Apa itu isoton
5. Perbandingan berdampingan - isotop vs isobar vs isoton dalam bentuk tabel
6. Ringkasan
Apa itu isotop?
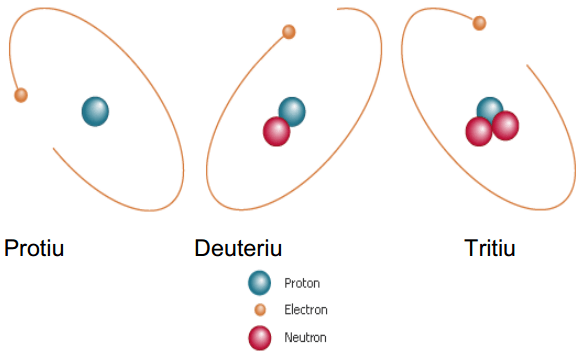
Isotop adalah atom dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Sejumlah proton dalam atom adalah jumlah atom dari atom itu. Elemen kimia tertentu memiliki jumlah proton yang tetap. Oleh karena itu, jumlah atom atom dari elemen kimia yang sama mirip satu sama lain. Oleh karena itu, isotop adalah atom dari elemen kimia yang sama. Jumlah total proton dan neutron dikenal sebagai massa atom. Isotop memiliki massa atom yang berbeda.
Perilaku kimia isotop elemen kimia identik, tetapi sifat fisiknya berbeda satu sama lain. Hampir semua elemen kimia memiliki isotop. Ada 275 isotop yang diketahui dari 81 elemen kimia yang stabil. Untuk elemen kimia tertentu, ada isotop yang stabil serta isotop radioaktif (tidak stabil).

Gambar 01: Isotop hidrogen
Isotop dinamai menggunakan nama elemen kimia dan massa atom isotop. Sebagai contoh, dua isotop helium tercatat sebagai "helium-2" dan "helium-4". Beberapa contoh isotop diberikan di bawah ini.

Apa itu Isobar?
Isobar adalah atom dari elemen kimia yang berbeda yang memiliki nilai yang sama untuk massa atom. Massa atom adalah jumlah proton dan neutron dalam inti atom. Proton atau neutron dikenal sebagai a Nucleon. Oleh karena itu, isobar memiliki jumlah nukleon yang sama.
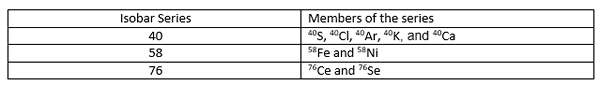
Jumlah atom isobar ini berbeda satu sama lain karena elemen kimia yang berbeda memiliki angka atom yang berbeda. Aturan Mattauch Isobar menyatakan bahwa jika dua elemen yang berdekatan pada tabel periodik memiliki isotop dengan jumlah massa yang sama (isobar), salah satu isotop ini harus radioaktif. Jika ada isobar dari tiga elemen berurutan, isobar pertama dan terakhir stabil, dan yang tengah dapat mengalami peluruhan radioaktif. Seri Isobar adalah kumpulan isotop berbeda yang memiliki massa atom yang sama.
Apa itu isoton?
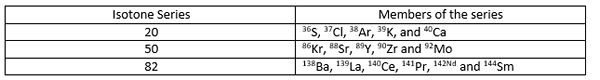
Isoton adalah atom dari berbagai elemen yang memiliki jumlah neutron yang sama dalam nukleus atom. Isoton memiliki angka atom yang berbeda (jumlah proton dalam nukleus berbeda satu sama lain) serta massa atom yang berbeda. Itu dapat dinyatakan seperti di bawah ini;
Nomor atom = z
Massa atom = a
Jumlah neutron = n
Untuk semua isoton dalam satu seri, ≠ z tetapi (a-z) = n (n adalah sama untuk semua isoton dalam satu seri). Beberapa contoh untuk isoton diberikan di bawah ini.
Apa perbedaan antara isotop dan isobar dan isoton?
Isotop vs isobar vs isoton | |
| Isotop | Isotop adalah atom dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. |
| Isobar | Isobar adalah atom dari elemen kimia yang berbeda yang memiliki nilai yang sama untuk massa atom. |
| Isoton | Isoton adalah atom dari berbagai elemen yang memiliki jumlah neutron yang sama dalam nukleus atom. |
| Nomor atom | |
| Isotop | Isotop memiliki nomor atom yang sama. |
| Isobar | Isobar memiliki angka atom yang berbeda. |
| Isoton | Isoton memiliki angka atom yang berbeda. |
| Massa atom | |
| Isotop | Isotop memiliki massa atom yang berbeda. |
| Isobar | Isobar memiliki massa atom yang sama. |
| Isoton | Isoton memiliki massa atom yang berbeda. |
| Jumlah neutron | |
| Isotop | Isotop memiliki jumlah neutron yang berbeda. |
| Isobar | Isobar memiliki jumlah neutron yang berbeda. |
| Isoton | Isoton jumlah neutron yang sama. |
Ringkasan - Isotop vs Isobar vs isoton
Isotop, isobar dan isoton adalah istilah yang digunakan untuk menggambarkan hubungan antara atom dari berbagai elemen kimia. Perbedaan antara isotop, isobar dan isoton adalah bahwa isotop adalah atom dengan jumlah proton yang sama, tetapi jumlah neutron dan isobar yang berbeda adalah atom dari elemen kimia yang berbeda yang memiliki nilai yang sama untuk massa atom sedangkan isoton adalah atom dari berbagai elemen yang memiliki jumlah yang sama yang sama neutron dalam nukleus atom.
Referensi:
1.Helmenstine, Anne Marie, D. “Definisi dan contoh isotop dalam kimia."Thoughtco, Aug. 4 2017. Tersedia disini
2.Editor Encyclopædia Britannica. “Isotone.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 Juli 1998. Tersedia disini
3.“Isobar (Nuclide)."Wikipedia, Wikimedia Foundation, 27 Des. 2017. Tersedia disini
4.Herzog, Gregory F. "Isotop.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 Des. 2017. Tersedia disini
Gambar milik:
1.'Izotopii Hidrogenului'by Nicolae Coman - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


