Perbedaan antara seri Lyman dan Balmer
Itu perbedaan utama Antara seri Lyman dan Balmer adalah itu Seri Lyman terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 1 sedangkan seri Balmer terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 2.
Seri Lyman dan Seri Balmer dinamai setelah para ilmuwan yang menemukan mereka. Fisikawan Theodore Lyman menemukan seri Lyman sementara Johann Balmer menemukan seri Balmer. Ini adalah jenis garis spektral hidrogen. Dua seri garis ini muncul dari spektrum emisi atom hidrogen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Seri Lyman
3. Seri apa itu Balmer
4. Perbandingan berdampingan - seri Lyman vs Balmer dalam bentuk tabel
5. Ringkasan
Seri Lyman?
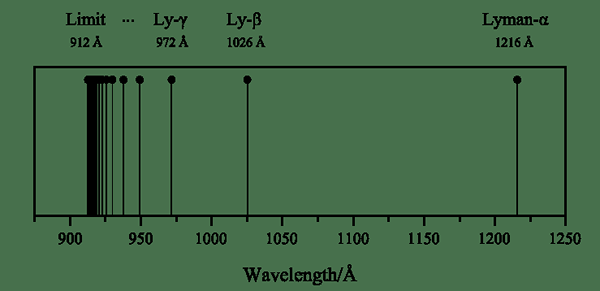
Lyman Series adalah seri garis spektral hidrogen yang terbentuk ketika elektron tereksitasi datang ke tingkat energi n = 1. Dan, tingkat energi ini adalah tingkat energi terendah dari atom hidrogen. Pembentukan seri baris ini disebabkan oleh garis emisi ultraviolet dari atom hidrogen.

Gambar 01: Seri Lyman
Selain itu, kita dapat menyebutkan setiap transisi menggunakan huruf Yunani; Transisi elektron tereksitasi dari n = 2 ke n = 1 adalah garis spektral lyman alpha, dari n = 3 hingga n = 1 adalah lyman beta, dan seterusnya. Fisikawan Theodore Lyman menemukan seri Lyman pada tahun 1906.
Seri apa itu Balmer?
Seri Balmer adalah seri garis spektral hidrogen yang terbentuk ketika elektron tereksitasi datang ke tingkat energi n = 2. Selanjutnya, seri ini menunjukkan garis spektral untuk emisi atom hidrogen, dan memiliki beberapa garis balmer ultraviolet yang menonjol yang memiliki panjang gelombang yang lebih pendek dari 400 nm.

Gambar 02: Seri Balmer
Seri Balmer dihitung menggunakan rumus Balmer, yang merupakan persamaan empiris yang ditemukan oleh Johann Balmer pada tahun 1885.
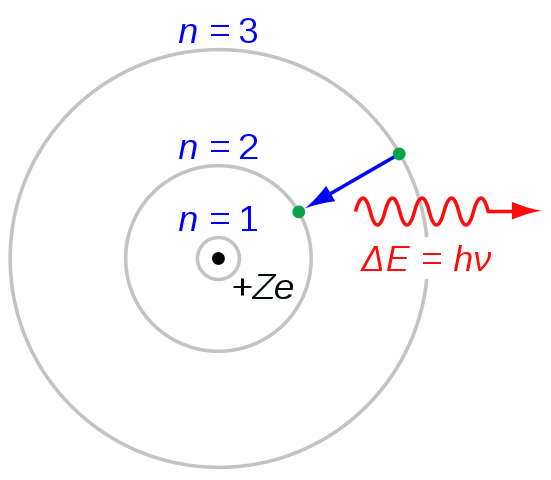
Gambar 03: Transisi Elektron untuk Pembentukan Seri Balmer
Saat memberi nama setiap baris dalam seri, kami menggunakan huruf "h" dengan huruf -huruf Yunani. Misalnya, dari n = 3 hingga n = 2 transisi memunculkan garis h-alpha, dari n = 4 hingga n = 2 memunculkan garis h-beta dan seterusnya. Huruf "H" adalah singkatan dari "Hidrogen". Saat mempertimbangkan panjang gelombang, garis spektral pertama adalah dalam kisaran spektrum elektromagnetik yang terlihat. Dan, baris pertama ini memiliki warna merah cerah.
Apa perbedaan antara seri Lyman dan Balmer?
Seri Lyman dan Balmer adalah seri garis spektral hidrogen yang muncul dari spektrum emisi hidrogen. Perbedaan utama antara seri Lyman dan Balmer adalah bahwa seri Lyman terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 1 sedangkan seri Balmer terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 2. Beberapa baris seri blamer berada dalam kisaran spektrum elektromagnetik yang terlihat. Tapi, seri Lyman berada di kisaran panjang gelombang UV.
Seri Lyman dan Seri Balmer dinamai setelah para ilmuwan yang menemukan mereka. Fisikawan Theodore Lyman menemukan seri Lyman sementara Johann Balmer menemukan seri Balmer. Saat menamai garis spektrum, kami menggunakan surat Yunani. Untuk baris dalam seri Lyman, namanya seperti Lyman Alpha, Lyman Beta dan sebagainya sedangkan untuk baris dalam seri Balmer nama-nama itu sebagai H-alpha, h-beta, dll.
Di bawah Infografis merangkum perbedaan antara seri Lyman dan Balmer.

Ringkasan -Seri Lyman vs Balmer
Seri Lyman dan Balmer adalah seri garis spektral hidrogen yang muncul dari spektrum emisi hidrogen. Perbedaan utama antara seri Lyman dan Balmer adalah bahwa seri Lyman terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 1, sedangkan seri Balmer terbentuk ketika elektron tereksitasi mencapai tingkat energi n = 2. Fisikawan Theodore Lyman menemukan seri Lyman sementara Johann Balmer menemukan seri Balmer.
Referensi:
1. “Seri Balmer.”Wikipedia, Wikimedia Foundation, 21 Okt. 2019, tersedia di sini.
2. “Seri Lyman."Wikipedia, Wikimedia Foundation, 7 Okt. 2019, tersedia di sini.
Gambar milik:
1. "Lymanseries" oleh Lymanseries1.GIF: Pengunggah asli adalah Adriferr di EN.Pekerjaan Wikipediaderivatif: Orangedog (Talk • Contribs) - Lymanseries1.gifvektorisasi dari aslinya. Presisi juga dikurangi untuk menyetujui sebagian besar sumber., (CC BY-SA 3.0) Via Commons Wikimedia
2. “Spektrum Hidrogen yang Terlihat” oleh Jan Homann - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
3. "Bohr Atom Model" oleh Jabberwok (CC BY-SA 3.0) Via Commons Wikimedia


