Perbedaan antara molaritas dan molalitas

Itu perbedaan utama Antara molaritas dan molalitas adalah molaritas Jumlah mol zat terlarut yang ada dalam 1 liter larutan sedangkan molalitas adalah jumlah mol zat terlarut yang ada dalam 1kg pelarut.
Molaritas dan molalitas adalah ukuran konsentrasi larutan. Konsentrasi larutan memberikan jumlah zat terlarut yang dilarutkan dalam jumlah satuan larutan. Kedua tindakan tersebut berbeda satu sama lain sesuai dengan parameter yang kami gunakan untuk mengukur jumlah satuan solusi; Molaritas mempertimbangkan volume larutan sementara molalitas mempertimbangkan massa pelarut. Namun, dalam kedua kasus, kami mengukur jumlah zat terlarut dalam mol.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu molaritas
3. Apa itu molalitas
4. Perbandingan berdampingan - molaritas vs molalitas dalam bentuk tabel
5. Ringkasan
Apa itu molaritas?
Molaritas adalah konsentrasi larutan yang diberikan oleh jumlah zat terlarut yang ada dalam satu liter solusi. Oleh karena itu, kami mengukur konsentrasi larutan melalui volume saat menentukan molaritas. Unit pengukuran adalah mol/L.

Gambar 01: Solusi yang berbeda memiliki konsentrasi yang berbeda tergantung pada volume larutan
Selain itu, parameter ini tergantung pada suhu larutan karena volume larutan dapat bervariasi dengan suhu, i.e. Hampir setiap kali volume cairan mengembang dengan meningkatnya suhu. Misalnya, larutan yang mengandung dua mol zat terlarut yang dilarutkan dalam satu liter larutan memiliki 2.0 Mol/L Konsentrasi. Kita dapat menunjukkan molaritas dengan "m".
Apa itu molalitas?
Molalitas adalah konsentrasi larutan yang diberikan oleh jumlah zat terlarut yang ada dalam satu kilogram pelarut. Oleh karena itu, kami mengukur konsentrasi larutan dengan menggunakan massa pelarut saat menentukan molalitas larutan. Oleh karena itu, unit pengukuran adalah mol/kg.
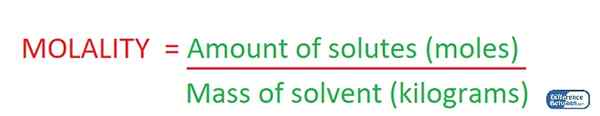
Gambar 02: Penentuan Molalitas Suatu Larutan
Selain itu, parameter ini tidak tergantung pada suhu larutan karena massa tidak berubah dengan suhu. Misalnya, jika suatu larutan mengandung 2 mol zat terlarut dalam satu kilogram pelarut, maka konsentrasi adalah 2.0 mol/kg. Kami biasanya menunjukkan istilah ini sebagai "m".
Apa perbedaan antara molaritas dan molalitas?
Molaritas adalah konsentrasi larutan yang diberikan oleh jumlah zat terlarut yang ada dalam satu liter larutan sedangkan molalitas adalah konsentrasi larutan yang diberikan oleh jumlah zat terlarut yang ada dalam satu kilogram pelarut. Oleh karena itu, ini adalah perbedaan utama antara molaritas dan molalitas. Selain itu, perbedaan penting antara molaritas dan molalitas adalah bahwa molaritas tergantung pada suhu larutan sementara molalitas tidak tergantung pada suhu. Ini terutama karena volume dapat berkembang dengan meningkatnya suhu sedangkan massa tetap konstan pada perubahan suhu.
Infografis di bawah ini menunjukkan perbedaan antara molaritas dan molalitas dalam bentuk tabel.
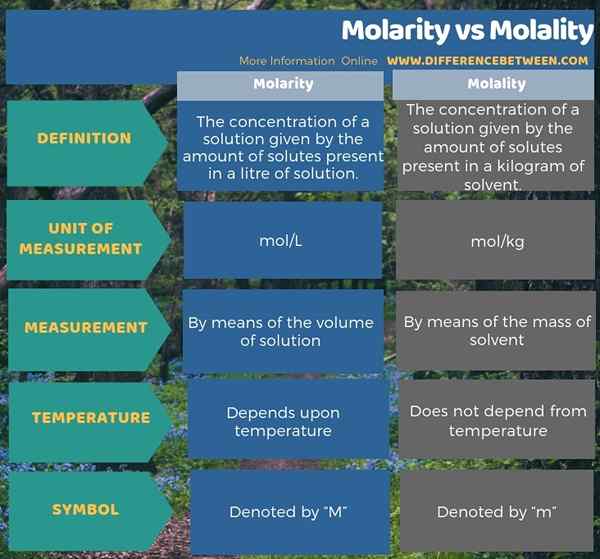
Ringkasan -Molaritas vs Molalitas
Molaritas dan molalitas adalah ukuran konsentrasi larutan. Perbedaan utama antara molaritas dan molalitas adalah bahwa molaritas adalah jumlah mol zat terlarut yang ada dalam 1 liter larutan sedangkan molalitas adalah jumlah mol zat terlarut yang ada dalam 1kg pelarut.
Referensi:
1. Mott, Vallerie. “Pengantar Kimia.”Lumen. Tersedia disini
2. “Konsentrasi molar."Wikipedia, Wikimedia Foundation, 17 Okt. 2018. Tersedia disini
Gambar milik:
1."217043" oleh publicdomainpictures (CC0) melalui Pixabay


