Perbedaan antara monatomik dan diatomik
Itu perbedaan utama antara monatomik dan diatomik adalah bahwa Spesies monatomik memiliki satu atom sedangkan spesies diatomik memiliki dua atom.
Oleh karena itu, perbedaan antara monatomik dan diatomik terutama berkaitan dengan atom yang ada pada spesies. Seperti nama yang disarankan, kedua istilah ini berdiri untuk berbagai keadaan asosiasi atom di mana 'mono' berarti 'satu' dan 'di' berarti 'dua.'Oleh karena itu, secara sederhana, monatomik berarti satu'satu atom'dan cara diatomik 'dua atom.'
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu monatomik
3. Apa diatomik
4. Perbandingan berdampingan - monatomik vs diatomik dalam bentuk tabel
5. Ringkasan
Apa itu monatomik?
Kapan satu atom ada sendiri (yang jarang terjadi), kami menyebutnya monatomik. Itu artinya, elemen -elemen itu dalam bentuk tunggal murni mereka. Namun, satu -satunya contoh praktis yang mungkin berada di bawah kategori ini adalah gas mulia yang ada sebagai atom sendiri karena mereka memiliki cangkang luar dengan oktet elektron lengkap. Oleh karena itu, mereka tidak ingin menerima atau menyumbangkan elektron lagi agar lebih stabil. Oleh karena itu, gas mulia stabil dalam bentuk monatomik. Beberapa contoh adalah; Dia - Helium, Ne - Neon, AR - Argon, Xe - Xenon, Kr - Krypton, RN - Radon.
Gambar 01: Monatomik berarti memiliki atom tunggal
Selain itu, ada juga atom tunggal dalam bentuk ionik terutama dalam solusi, dan beberapa contoh adalah; Na+, Ca2+, K+ dll. Ion -ion ini memiliki muatan tetap pada mereka yang berarti bahwa mereka memiliki valensi yang konstan. Tapi, ada jenis ion lain yang memiliki banyak valensi dan dapat ada dalam banyak bentuk ionik, masih monatomik. Contoh yang baik adalah besi; Fe2+ dan fe3+. Dengan demikian, tidak hanya kation (bermuatan positif) tetapi anion (bermuatan negatif) juga ada dalam bentuk monatomik; Cl-, F-, SAYA- adalah beberapa contoh yang ada dalam bentuk monatomik. Spesies ionik ini tidak stabil sendiri dan secara alami akan mencari rekan -rekan untuk membentuk senyawa.
Tetapi, seperti yang disebutkan di atas, kita dapat menemukannya dalam solusi pada hidrolisis senyawa mereka. Bentuk spesies ionik karena kurangnya stabilitas atom tunggal dalam bentuk murni yang tidak dapat mencapai konfigurasi elektronik gas mulia. Oleh karena itu, atom -atom ini menerima atau menyumbangkan elektron untuk mendapatkan stabilitas.
Apa diatomik?
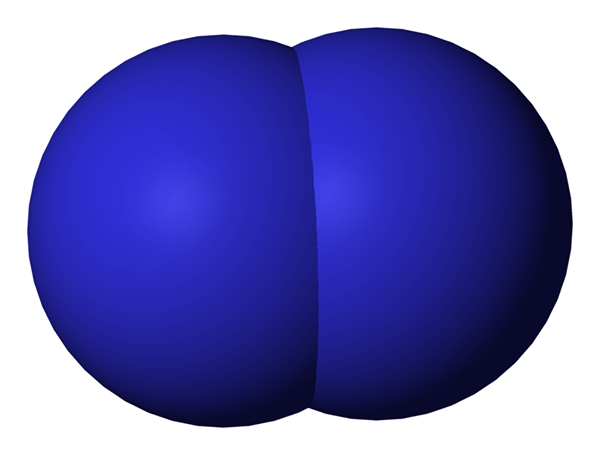
Kapan Dua atom berhubungan satu sama lain, kami menyebutnya diatomik. Atom -atom ini dapat terjadi sebagai tipe yang sama atau berbeda. Ketika mereka adalah dua atom serupa dalam asosiasi kami menyebutnya 'Diatom homonuklear'Dan jika mereka terdiri dari berbagai jenis, kami menyebutnya'Diatom heteronuklear'. Contoh beberapa diatom homonuklear adalah o2, N2, H2, dll. Sedangkan CO, tidak, HCl, dll. dapat diberikan sebagai contoh untuk diatom heteronuklear.

Gambar 02: Diatomik berarti memiliki dua atom
Kita dapat menganggap diatom sebagai senyawa karena mereka membentuk asosiasi ini untuk mencapai lebih banyak stabilitas dengan berbagi elektron satu sama lain sehingga kedua atom mencapai konfigurasi elektronik gas mulia. Mereka dapat mengikat melalui ikatan kovalen dengan tumpang tindih orbital atom atau mereka dapat membentuk ikatan ionik di antara mereka, yang merupakan daya tarik antara spesies kation (bermuatan positif) dan spesies anion (bermuatan negatif) negatif). Contoh ikatan kovalen di antara diatom termasuk CO, tidak, dll. Dan kami menganggap HCl sebagai spesies dengan karakter objek wisata ionik. Namun, sebagai kekuatan daya tarik antara h+ dan Cl- tidak terlalu kuat, ini bukan contoh yang sangat baik untuk ikatan ionik yang merupakan topik lain yang ditentukan.
Apa perbedaan antara monatomik dan diatomik?
Istilah monatomik mengacu pada keberadaan satu atom sedangkan istilah diatomik mengacu pada keberadaan dua atom yang berhubungan satu sama lain. Oleh karena itu, perbedaan utama antara monatomik dan diatomik adalah bahwa spesies monatomik memiliki satu atom sedangkan spesies diatomik memiliki dua atom. Selain itu, perbedaan lain antara monatomik dan diatomik adalah bahwa spesies monatomik umumnya tidak stabil dengan pengecualian gas mulia sementara spesies diatomik umumnya stabil karena ada ikatan kimia antara dua atom yang terbentuk untuk menyelesaikan oktet elektron di sekitar masing -masing atom.
Infografis di bawah ini menunjukkan perbedaan antara monatomik dan diatomik dalam bentuk tabel.

Ringkasan -monatomik vs diatomik
Dua istilah monatomik dan diatomik menggambarkan jumlah atom yang ada dalam spesies kimia. Oleh karena itu, perbedaan utama antara monatomik dan diatomik adalah bahwa spesies monatomik memiliki satu atom sedangkan spesies diatomik memiliki dua atom.
Referensi:
1. “Gas Monatomik."Wikipedia, Wikimedia Foundation, 17 September. 2018. Tersedia disini
Gambar milik:
1.”Monatomic-Sodium-Gas-3D-VDW” oleh Benjah-BMM27-karya sendiri, (domain publik) via Commons Wikimedia
2.”Dinitrogen-3D-VDW” (domain publik) via Commons Wikimedia


