Perbedaan antara monovalen dan divalen
Itu perbedaan utama antara monovalen dan divalen adalah itu Elemen monovalen dapat menghilangkan atau mendapatkan satu elektron agar menjadi stabil, sedangkan elemen divalen dapat menghilangkan atau mendapatkan dua elektron agar stabil.
Istilah monovalen dan divalen dapat menggambarkan valensi elemen kimia. Dua istilah ini menggambarkan jumlah elektron yang dapat diperoleh atau kehilangan untuk mencapai konfigurasi elektron yang stabil.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu valensi
3. Apa itu monovalen
4. Apa itu divalen
5. Perbandingan berdampingan - monovalen vs divalen dalam bentuk tabel
6. Ringkasan
Apa itu valensi?
Valensi dapat digambarkan sebagai jumlah elektron maksimum yang dapat dilihat oleh atom, gain atau berbagi untuk menjadi stabil. Saat mempertimbangkan logam dan bukan logam, aturan oktet menggambarkan bentuk atom yang paling stabil. Menurut aturan oktet, jika cangkang terluar atom sepenuhnya diisi dengan delapan elektron, konfigurasi itu stabil. Ini berarti jika sub-orbital S dan P sepenuhnya terisi, memiliki NS2np6, Konfigurasi elektron ini stabil. Secara umum, atom gas mulia memiliki konfigurasi elektron jenis ini. Ini menunjukkan bahwa elemen kimia lain perlu kehilangan, mendapatkan atau berbagi elektron untuk mematuhi aturan oktet. Jumlah maksimum elektron yang terlibat dalam proses stabilisasi ini disebut valensi atom itu.
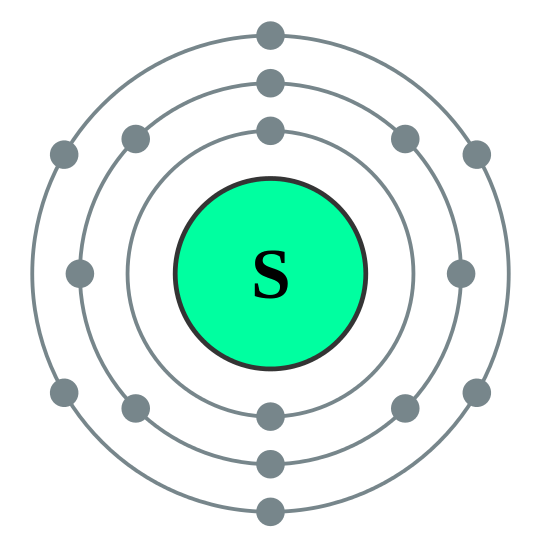
Misalnya, jumlah elektron di orbital sulfur terluar adalah 6. Untuk menjadi stabil, jumlah elektron di orbital terluar harus 8 (sesuai dengan aturan oktet). Belerang harus mendapatkan atau berbagi dua elektron lagi dari luar. Oleh karena itu, valensi belerang adalah 2.
Namun, elemen transisi dapat memiliki valensi yang berbeda. Ini karena logam transisi dapat distabilkan dengan menghilangkan jumlah elektron yang berbeda.
Apa itu monovalen?
Istilah monovalen berarti memiliki valensi satu. Istilah lain untuk nama ini adalah univalen, artinya, “valency = satu”. Atom monovalen dapat membentuk ikatan kimia tunggal karena atom -atom ini dapat kehilangan atau hanya mendapatkan satu elektron agar menjadi stabil. Beberapa atom cenderung berbagi elektron tunggal ini, membentuk ikatan kovalen tunggal, e.G. kebanyakan non -logam. Tetapi beberapa atom cenderung sepenuhnya menghilangkan atau mendapatkan elektron, membentuk ikatan ionik, e.G. logam. Unsur kimia dalam kelompok 1 dari tabel periodik (logam alkali) biasanya monovalen karena mereka hanya dapat kehilangan satu elektron yang ada di orbital S terluar.
Apa itu divalen?
Istilah divalen berarti memiliki valensi dua. Atom divalen dapat membentuk dua ikatan kimia karena atom -atom ini dapat kehilangan atau mendapatkan dua elektron untuk mendapatkan konfigurasi elektron yang stabil. Beberapa atom divalen cenderung membentuk dua ikatan kovalen tunggal dengan berbagi dua elektron ini dengan dua atom yang berbeda. Beberapa atom cenderung membentuk ikatan rangkap dengan atom lain dengan berbagi dua elektron ini. Namun, logam 2 logam dalam tabel periodik cenderung membentuk ikatan ionik dengan anion divalen dengan sepenuhnya menghilangkan dua elektron yang berada di orbital atom S paling terluar.
Apa perbedaan antara monovalen dan divalen?
Istilah monovalen dan divalen adalah kata sifat yang menggambarkan valensi atom. Perbedaan utama antara monovalen dan divalen adalah bahwa elemen monovalen dapat menghilangkan atau mendapatkan satu elektron agar menjadi stabil, sedangkan elemen divalen dapat menghilangkan atau mendapatkan dua elektron agar menjadi stabil. Selain itu, elemen kimia dalam kelompok 1 dari tabel periodik (logam alkali) biasanya monovalen sedangkan elemen dalam kelompok 2 dari tabel periodik adalah divalen.
Di bawah ini adalah ringkasan tabulasi perbedaan antara monovalen dan divalen.
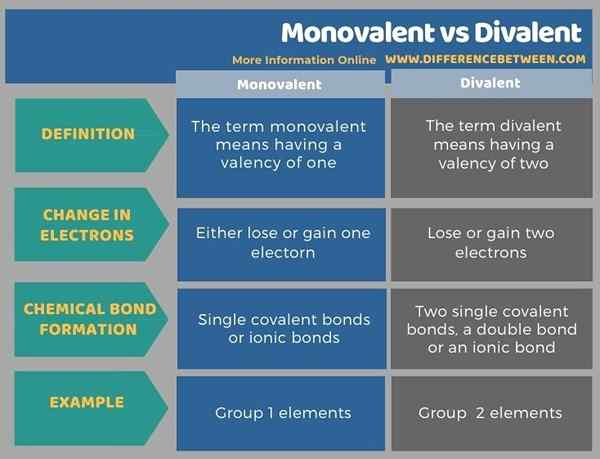
Ringkasan -monovalen vs divalen
Istilah monovalen dan divalen adalah kata sifat yang menggambarkan valensi atom. Perbedaan utama antara monovalen dan divalen adalah bahwa elemen monovalen dapat menghilangkan atau mendapatkan satu elektron agar menjadi stabil, sedangkan elemen divalen dapat menghilangkan atau mendapatkan dua elektron agar menjadi stabil.
Referensi:
1. “Valensi (Kimia)." Wikipedia, Wikimedia Foundation, 1 September. 2020, tersedia di sini.
Gambar milik:
1. “Electron Shell 016 Sulphur” oleh Pumbaa (karya asli oleh Greg Robson) - Aplikasi: (dihasilkan oleh skrip) (CC BY -SA 2.0 uk) via commons wikimedia


