Perbedaan antara persamaan Nernst dan persamaan Goldman
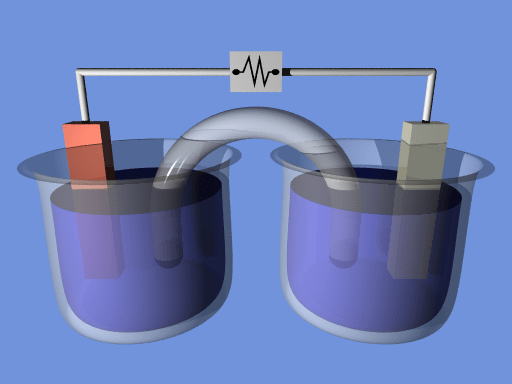
Itu perbedaan utama Antara persamaan Nernst dan persamaan Goldman adalah itu Persamaan Nernst menggambarkan hubungan antara potensi reduksi dan potensial elektroda standar, sedangkan persamaan Goldman adalah turunan dari persamaan Nernst dan menggambarkan potensi pembalikan di seluruh membran sel.
Sel elektrokimia adalah alat listrik yang dapat menghasilkan listrik menggunakan energi kimia reaksi kimia. Atau kita dapat menggunakan perangkat ini untuk membantu reaksi kimia melalui menyediakan energi yang diperlukan dari listrik. Potensi reduksi sel elektrokimia menentukan kemampuan sel untuk menghasilkan listrik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa persamaan nernst
3. Apa persamaan Goldman
4. Perbandingan berdampingan - persamaan nernst vs. Persamaan Goldman dalam bentuk tabel
5. Ringkasan
Apa persamaan nernst?
Persamaan Nernst adalah ekspresi matematika yang memberikan hubungan antara potensi reduksi dan potensi reduksi standar sel elektrokimia. Persamaan ini dinamai oleh ilmuwan Walther Nernst. Dan, dikembangkan dengan menggunakan faktor -faktor lain yang mempengaruhi reaksi oksidasi elektrokimia dan reduksi, seperti suhu dan aktivitas kimia spesies kimia yang mengalami oksidasi dan reduksi.

Saat mendapatkan persamaan Nernst, kita harus mempertimbangkan perubahan standar energi bebas Gibbs yang terkait dengan transformasi elektrokimia yang terjadi di dalam sel. Reaksi reduksi sel elektrokimia dapat diberikan sebagai berikut:
Sapi+ z e- ⟶ merah
Menurut termodinamika, perubahan energi bebas yang sebenarnya dari reaksi adalah,
E = epengurangan - Eoksidasi
Namun, Gibbs Free Energy (ΔG) terkait dengan E (perbedaan potensial) sebagai berikut:
ΔG = -nfe
Di mana n adalah jumlah elektron yang ditransfer antara spesies kimia saat reaksi berlangsung, f adalah konstanta faraday. Jika kita mempertimbangkan kondisi standar, maka persamaannya adalah sebagai berikut:
ΔG0 = -Nfe0
Kita dapat menghubungkan energi bebas Gibbs dari kondisi non-standar dengan energi Gibbs dari kondisi standar melalui persamaan berikut.
ΔG = ΔG0 + Rtlnq
Kemudian, kita dapat mengganti persamaan di atas ke dalam persamaan standar ini untuk mendapatkan persamaan Nernst sebagai berikut:
-nfe = -nfe0 + Rtlnq

Namun, kita dapat menulis ulang persamaan di atas menggunakan nilai untuk konstanta faraday dan r (konstanta gas universal).
E = e0 - (0.0592vlnq/n)
Apa persamaan Goldman?
Persamaan Goldman berguna dalam menentukan potensi terbalik melintasi membran sel dalam fisiologi membran sel. Persamaan ini dinamai setelah ilmuwan David E. Goldman, yang mengembangkan persamaan. Dan, itu berasal dari persamaan Nernst. Persamaan Goldman memperhitungkan distribusi ion yang tidak merata di seluruh membran sel dan perbedaan dalam permeabilitas membran saat menentukan potensi terbalik ini. Persamaannya adalah sebagai berikut:
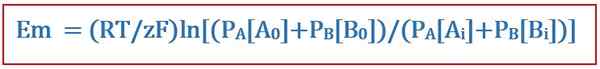
Di mana
- EM adalah perbedaan potensial di seluruh membran sel,
- R adalah konstanta gas universal,
- T adalah suhu termodinamika,
- Z adalah jumlah mol elektron yang ditransfer antar spesies kimia,
- F adalah konstanta faraday,
- PA atau B adalah permeabilitas membran terhadap ion atau b, dan
- [A atau B]Saya adalah konsentrasi ion A atau B di dalam membran sel.
Apa perbedaan antara persamaan Nernst dan persamaan Goldman?
Persamaan Nernst dan Persamaan Goldman adalah ekspresi matematika yang dapat digunakan sebagai pengukuran potensial sel elektrokimia. Perbedaan utama antara persamaan Nernst dan persamaan Goldman adalah bahwa persamaan Nernst menggambarkan hubungan antara potensi reduksi dan potensial elektroda standar, sedangkan persamaan Goldman adalah turunan dari persamaan Nernst dan menggambarkan potensi pembalikan melintasi membran sel sel sel sebuah membran sel sel sel.
Infografis di bawah ini merangkum perbedaan antara persamaan Nernst dan persamaan Goldman.

Ringkasan -Persamaan Nernst vs Persamaan Goldman
Persamaan Nernst dan Persamaan Goldman adalah ekspresi matematika yang dapat digunakan sebagai pengukuran potensial sel elektrokimia. Perbedaan utama antara persamaan Nernst dan persamaan Goldman adalah bahwa persamaan Nernst menggambarkan hubungan antara potensi reduksi dan potensial elektroda standar, tetapi persamaan Goldman adalah turunan dari persamaan Nernst dan menggambarkan potensi pembalikan di seluruh membran sel sel sel.
Referensi:
1. “Persamaan Nernst.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "Electrochemcell" oleh Alksub di Inggris Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia


