Perbedaan antara asam nitrat dan asam nitrat
Itu perbedaan utama Antara asam nitrat dan asam nitrat adalah itu Molekul asam nitrat mengandung tiga atom oksigen yang terikat pada atom nitrogen sentral sedangkan molekul asam nitrat mengandung dua atom oksigen yang terikat pada atom nitrogen sentral.
Asam nitrat dan nitrat adalah asam nitrogen anorganik. Kedua asam ini mengandung atom nitrogen, oksigen dan hidrogen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam nitrat
3. Apa itu asam nitrat
4. Perbandingan berdampingan - asam nitrat vs asam nitrat dalam bentuk tabel
5. Ringkasan
Apa itu asam nitrat?
Asam nitrat memiliki formula kimia HNO3. Itu adalah asam yang sangat korosif dan berbahaya. Selain itu, ia dapat memiliki sifat kimia encer atau terkonsentrasi. Either way, ia memiliki molekul asam nitrat yang dilarutkan dalam air. Reaksi antara nitrogen dioksida dan air membentuk asam nitrat. Ada dua jenis asam nitrat: asam nitrat marah dan asam nitrat pekat.
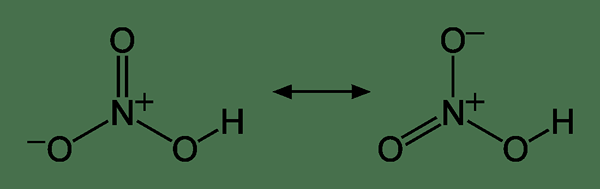
Gambar 01: Struktur resonansi molekul asam nitrat
Asam nitrat marah adalah tingkat asam nitrat komersial yang memiliki konsentrasi yang sangat tinggi dan kepadatan tinggi. Ini berisi 90-99% HNO3. Kita dapat menyiapkan cairan ini dengan menambahkan nitrogen dioksida yang berlebihan ke asam nitrat. Itu membentuk cairan fuming yang tidak berwarna, kekuningan atau kecoklatan yang sangat korosif. Oleh karena itu, larutan asam ini memiliki molekul gas dalam kombinasi dengan air; Tidak ada air di dalamnya. Asap asam ini naik dari permukaan asam; Ini mengarah pada namanya, "marah". Formula kimia senyawa ini adalah hno3-xTIDAK2.
Asam nitrat terkonsentrasi hanyalah larutan yang mengandung lebih banyak asam nitrat dalam air yang lebih sedikit. Itu berarti bentuk asam terkonsentrasi mengandung jumlah air yang lebih sedikit dibandingkan dengan jumlah zat terlarut di dalamnya. Dalam skala komersial, 68% atau ke atas dianggap sebagai asam nitrat terkonsentrasi. Selain itu, kepadatan solusi ini adalah 1.35 g/cm3. Banyak konsentrasi ini tidak menghasilkan asap, tetapi konsentrasi asam ini sangat tinggi dapat memberikan asap berwarna putih. Kita dapat menghasilkan cairan ini dengan bereaksi nitrogen dioksida dengan air.
Apa itu asam nitrat?
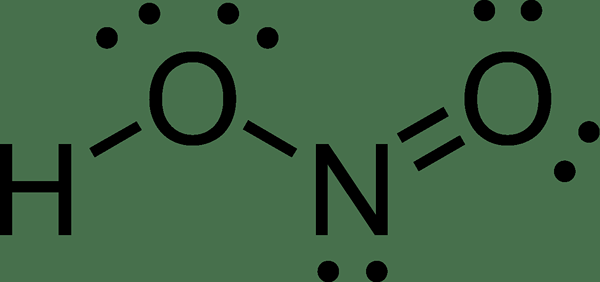
Asam nitro adalah asam anorganik yang memiliki formula kimia HNO2. Itu adalah asam lemah dan asam monoprotik. Asam ini terjadi dalam keadaan larutan, dalam fase gas, dan dalam bentuk garam nitril. Asam ini berguna dalam membuat garam diazonium yang merupakan reagen dalam reaksi kopling azo untuk memberikan pewarna azo.

Gambar 02: Struktur asam nitrat
Larutan asam nitrat muncul dalam warna biru pucat. Basa konjugat dari asam ini adalah ion nitril. Dalam fase gasnya, asam nitrat ada di geometri planar, dan dapat mengadopsi bentuk cis dan trans. Isomer trans mendominasi pada suhu kamar, dan stabil dari isomer cis.
Asam nitrat dapat dibuat dengan pengasaman larutan air nitrium nitrit dengan asam mineral. Kita dapat melakukan proses pengasaman pada suhu es, dan HNO2 dikonsumsi dalam kondisi situ. Molekul asam nitrat bebas tidak stabil dan cenderung terurai dengan cepat. Selain itu, kita dapat menghasilkan asam nitrat melalui melarutkan dinitrogen trioksida dalam air.
Apa perbedaan antara asam nitrat dan asam nitrat?
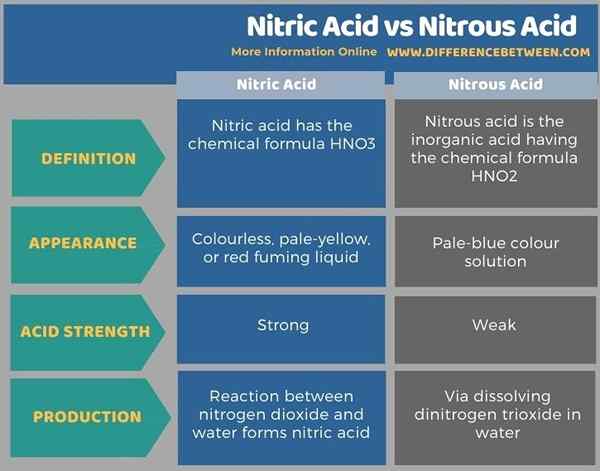
Asam nitrat dan asam nitrat adalah asam anorganik yang mengandung atom nitrogen. Perbedaan utama antara asam nitrat dan asam nitrat adalah bahwa molekul asam nitrat mengandung tiga atom oksigen yang terikat pada atom nitrogen sentral sedangkan molekul asam nitrat mengandung dua atom oksigen yang terikat pada atom nitrogen sentral sentral.
Selain itu, perbedaan yang mudah diidentifikasi antara asam nitrat dan asam nitrat adalah bahwa asam nitrat adalah cairan fuming merah yang tidak berwarna, pucat, atau merah sedangkan asam nitrat adalah larutan warna biru pucat pucat. Selain itu, asam nitrat adalah asam yang kuat dari asam nitrat.
Di bawah infografis tabulasi perbedaan antara asam nitrat dan asam nitrat.
Ringkasan -asam nitrat vs asam nitrat
Asam nitrat dan asam nitrat adalah asam anorganik yang mengandung atom nitrogen. Perbedaan utama antara asam nitrat dan asam nitrat adalah bahwa molekul asam nitrat mengandung tiga atom oksigen yang terikat pada atom nitrogen sentral sedangkan molekul asam nitrat mengandung dua atom oksigen yang terikat pada atom nitrogen sentral sentral.
Referensi:
1. Asam nitro. (N.D.). Sciencedirect. Diperoleh 13 Oktober 2020, tersedia di sini.
Gambar milik:
1. “Nitric-Acid-Resonance-A” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia
2. “Nitrous Acid ACSV” oleh Calvero - karya sendiri (domain publik) melalui Commons Wikimedia


