Perbedaan antara konfigurasi gas mulia dan konfigurasi elektron
Itu perbedaan utama antara konfigurasi gas mulia dan konfigurasi elektron adalah itu A Konfigurasi gas mulia hanya memiliki pasangan elektron sedangkan konfigurasi elektron dapat memiliki elektron berpasangan dan tidak berpasangan.
Istilah konfigurasi elektron mengacu pada urutan elektron atau urutan elektron yang ada dalam atom elemen kimia tertentu. Istilah konfigurasi elektron gas mulia menunjukkan bahwa semua orbital atom sepenuhnya diisi dengan elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu konfigurasi gas mulia
3. Apa itu konfigurasi elektron
4. Perbandingan Berdampingan - Konfigurasi Gas Noble vs Konfigurasi Elektron Dalam Bentuk Tabel
5. Ringkasan
Apa itu konfigurasi gas mulia?
Konfigurasi gas mulia adalah konfigurasi elektron atom gas mulia. Atom gas mulia adalah atom dari elemen kimia kelompok 18 di tabel periodik. Elemen kimia Grup 18 dikenal sebagai unsur gas mulia karena dua alasan; Pertama, unsur -unsur kimia ini sebagian besar tidak reaktif karena konfigurasi elektron yang sudah selesai, dan alasan kedua adalah bahwa elemen kimia ini terjadi pada fase gas di alam.

Gambar 01: Gas mulia yang berbeda
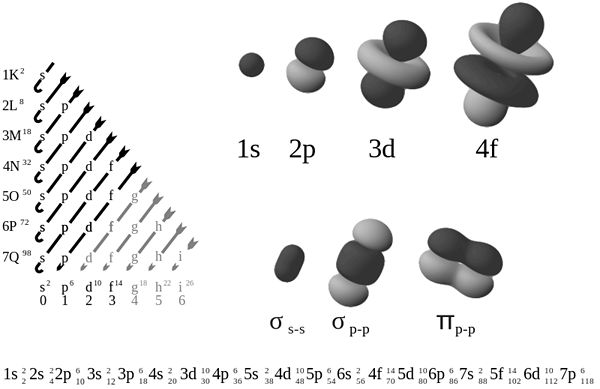
Ada empat jenis utama orbital atom dalam elemen kimia; s orbital, p orbital, d orbital dan orbital. Orbital atom S mengandung maksimum dua elektron, orbital P dapat menampung enam elektron, orbital D dapat menampung sepuluh elektron, dan orbital dapat menampung 14 elektron. Dalam elemen kimia Grup 18, kita dapat mengamati konfigurasi elektron S2P6; Di sini, orbital atom S dan P sepenuhnya diisi dengan elektron. Oleh karena itu, tidak ada elektron yang tidak berpasangan dalam atom -atom ini.
Apa itu konfigurasi elektron?
Konfigurasi elektron adalah distribusi elektron atom dalam orbital atomnya. Istilah ini menggambarkan setiap elektron dalam atom sebagai bergerak secara independen dalam orbital, dalam bidang rata -rata yang dibuat oleh semua orbital lainnya.
Konfigurasi elektron atom dapat dinyatakan sebagai urutan elektron yang ada dalam atom itu dalam bentuk distribusi di seluruh orbital atom atom itu. Beberapa elemen kimia seperti atom gas mulia telah menyelesaikan orbital atom, dan tidak ada elektron yang tidak berpasangan; Namun, sebagian besar elemen kimia yang kita tahu memiliki elektron yang tidak berpasangan dalam konfigurasi elektron mereka. Misalnya, konfigurasi elektron atom neon, atom gas mulia, memiliki konfigurasi elektron 1s22s22p6.

Dengan melihat konfigurasi elektron atom, kita dapat menggambarkan reaktivitas atom itu. Orbital atom yang sepenuhnya terisi menunjukkan sifat yang tidak reaktif karena tidak harus mendapatkan elektron lagi untuk menstabilkan dirinya sendiri. Sebaliknya, dalam atom yang memiliki elektron yang tidak berpasangan sering cenderung sangat reaktif untuk menstabilkan konfigurasi elektron mereka.
Apa perbedaan antara konfigurasi gas mulia dan konfigurasi elektron?
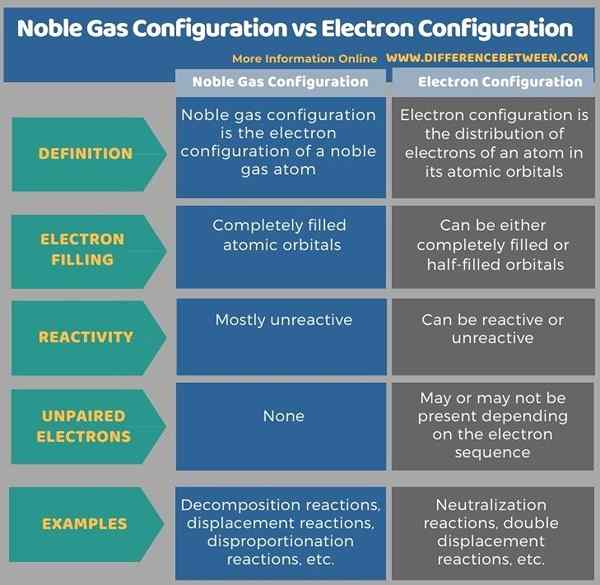
Konfigurasi gas mulia adalah konfigurasi elektron atom gas mulia; Ini berarti, atom telah sepenuhnya mengisi orbital atom. Perbedaan utama antara konfigurasi gas mulia dan konfigurasi elektron adalah bahwa konfigurasi gas mulia hanya memiliki pasangan elektron sedangkan konfigurasi elektron dapat memiliki elektron berpasangan dan tidak berpasangan. Itu berarti; Konfigurasi gas mulia telah sepenuhnya mengisi orbital atom sementara konfigurasi elektron dapat memiliki orbital yang sepenuhnya diisi atau setengah diisi.
Di bawah daftar infografis lebih banyak perbedaan antara konfigurasi gas mulia dan konfigurasi elektron.
Ringkasan -Konfigurasi Gas Noble vs Konfigurasi Elektron
Konfigurasi elektron adalah urutan elektron yang ada dalam atom. Perbedaan utama antara konfigurasi gas mulia dan konfigurasi elektron adalah bahwa konfigurasi gas mulia hanya memiliki pasangan elektron sedangkan konfigurasi elektron dapat memiliki elektron berpasangan dan tidak berpasangan.
Referensi:
1. "Gas mulia.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 23 Oktober. 2020, tersedia di sini.
Gambar milik:
1. "Gas Noble Bersinar" oleh karya baru Alchemist-HP (Talk) www.PSE-Mendelejew.de); Gambar Tunggal Asli: Jurii, http: // gambar-of-elemen.com. - Asli: Jurii (CC oleh 3.0) Via Commons Wikimedia
2. "Orbital Elektron" oleh Patricia.FIDI - Pekerjaan sendiri oleh Patricia.Fidi dan Lt Paul - Berasal dari PL: Grafika: Orbitale.PNG, Penulis PL: WikipedySta: ChemMix.W3C- (domain publik) ini melalui Commons Wikimedia


