Perbedaan antara penambahan oksidatif dan eliminasi reduktif
Itu perbedaan utama Antara penambahan oksidatif dan eliminasi reduktif adalah itu Penambahan oksidatif mengacu pada penambahan dua ligan anionik ke kompleks logam, sedangkan eliminasi reduktif mengacu pada pengangkatan dua ligan anionik dari kompleks logam.
Penambahan oksidatif dan eliminasi reduktif adalah reaksi kimia yang saling berlawanan. Kedua proses ini terkait dengan kompleks koordinasi yang mengandung logam transisi dan ligan yang melekat padanya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa penambahan oksidatif
3. Apa eliminasi reduktif
4. Perbandingan berdampingan -Penambahan oksidatif vs eliminasi reduktif dalam bentuk tabel
5. Ringkasan
Apa penambahan oksidatif
Penambahan oksidatif adalah jenis reaksi anorganik di mana dua ligan anionik melekat pada kompleks koordinasi. Kita dapat menunjukkan proses ini sebagai OA. Di sini, ligan anionik biasanya terbentuk dari molekul tipe A-B. Proses terbalik yang tepat dari reaksi ini - di mana dua ligan anionik meninggalkan kompleks koordinasi yang membentuk molekul tipe A -B - dikenal sebagai eliminasi reduktif. Karena reaksi ini melibatkan peningkatan jumlah ligan di kompleks koordinasi, jumlah koordinasi juga meningkat dengan penambahan oksidatif. Oleh karena itu, jumlah elektron valensi kompleks juga meningkat dengan dua unit. Agar jenis reaksi ini terjadi, kompleks koordinasi harus tidak jenuh atau kekurangan elektron.
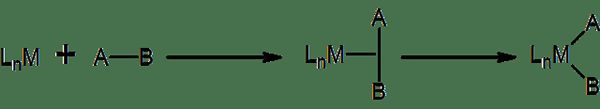
Gambar 01: Sketsa Umum untuk Penambahan Oksidatif
Secara umum, penambahan oksidatif mengubah kompleks koordinasi elektron 16-valensi menjadi kompleks elektron 18-valensi. Selain itu, penambahan oksidatif dapat terjadi sebagai penambahan oksidatif binuklear. Di sini, dua pusat logam mengalami perubahan keadaan oksidasi, dan keadaan oksidasi mereka meningkat satu unit, yang memberikan total peningkatan dua unit.
Apa eliminasi reduktif?
Eliminasi reduktif adalah penghapusan dua ligan anionik dari kompleks logam, yang merupakan kebalikan dari reaksi penambahan oksidatif. Proses ini mengurangi keadaan oksidasi formal dari logam dari kompleks koordinasi, dan jumlah koordinasi berkurang dengan dua unit.

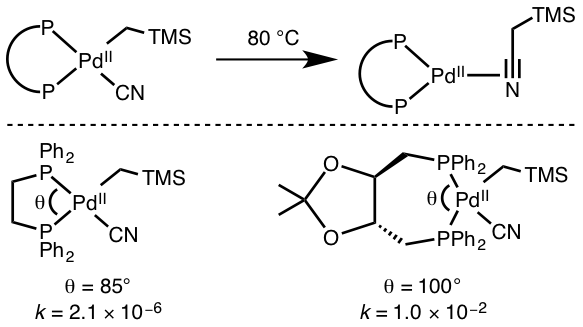
Gambar 02: Sketsa Umum untuk Eliminasi Reduktif
Kita dapat mengamati jenis reaksi dalam kompleks koordinasi yang mengandung logam yang memiliki d6 dan d8 Sistem Elektron. Jenis reaksi ini dapat terjadi dengan konversi kompleks elektron 18-valensi menjadi kompleks elektron 16-valensi dan melalui reaksi eliminasi binuclear. Dalam reaksi eliminasi binuklear, dua kompleks logam mengurangi keadaan oksidasi formal dengan satu unit dan memberikan reduksi dua unit keadaan oksidasi formal dan jumlah elektron valensi.
Apa perbedaan antara penambahan oksidatif dan eliminasi reduktif?
Penambahan oksidatif dan eliminasi reduktif adalah reaksi yang berlawanan satu sama lain. Perbedaan utama antara penambahan oksidatif dan eliminasi reduktif adalah bahwa penambahan oksidatif mengacu pada penambahan dua ligan anionik ke kompleks logam, sedangkan eliminasi reduktif mengacu pada pengangkatan dua ligan anionik dari kompleks logam. Selain itu, dalam penambahan oksidatif, jumlah elektron valensi dan keadaan oksidasi formal meningkat dengan dua unit, tetapi dalam reaksi eliminasi reduktif, keadaan oksidasi formal dan jumlah elektron valensi berkurang dengan dua unit.
Di bawah ini adalah deskripsi terperinci tentang perbedaan antara penambahan oksidatif dan eliminasi reduktif.

Ringkasan -Penambahan Oksidatif vs Eliminasi Reduktif
Penambahan oksidatif dan eliminasi reduktif adalah reaksi kimia yang saling berlawanan. Perbedaan utama antara penambahan oksidatif dan eliminasi reduktif adalah bahwa penambahan oksidatif mengacu pada penambahan dua ligan anionik ke kompleks logam, sedangkan eliminasi reduktif mengacu pada pengangkatan dua ligan anionik dari kompleks logam.
Referensi:
1.“10.1: Penambahan oksidatif dan eliminasi reduktif.”Kimia Libretexts, Libretexts, 13 Okt. 2019, tersedia di sini.
2. “5.5: Penambahan Oksidatif.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
3. “Penambahan oksidatif.”Wikipedia, Wikimedia Foundation, 9 Nov. 2019, tersedia di sini.
4. “Eliminasi Reduktif: Ide Umum.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "OA Concerter" oleh Rifleman 82 (Talk) - Rifleman 82 (bicara) (domain publik) melalui Commons Wikimedia
2. "Reductive Elimination Bite Angles" oleh Jgurak - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


