Perbedaan antara kelimpahan persen dan kelimpahan relatif
Perbedaan utama - persen kelimpahan vs kelimpahan relatif
Persen kelimpahan dan kelimpahan relatif adalah persentase nilai elemen kimia yang mewakili kejadiannya di lingkungan. Perbedaan utama antara kelimpahan persen dan kelimpahan relatif adalah bahwa Persen kelimpahan memberikan kelimpahan isotop sedangkan kelimpahan relatif memberikan kelimpahan elemen kimia. Persentase kelimpahan dapat digunakan untuk menentukan massa atom rata -rata dari elemen kimia tertentu. Kelimpahan relatif memberikan terjadinya elemen kimia tertentu dalam lingkungan tertentu, i.e, di bumi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Berapa persen kelimpahan
3. Apa itu kelimpahan relatif
4. Kesamaan antara kelimpahan persen dan kelimpahan relatif
5. Perbandingan berdampingan -persentase kelimpahan vs kelimpahan relatif dalam bentuk tabel
6. Ringkasan
Berapa persen kelimpahan?
Persen kelimpahan adalah jumlah persentase dari semua isotop yang terjadi secara alami dari suatu elemen. Isotop adalah atom dari elemen yang sama yang memiliki angka atom yang identik tetapi jumlah massa yang berbeda. Ini berarti isotop adalah atom yang memiliki jumlah proton yang sama dalam nukleus atom, tetapi jumlah neutron yang berbeda.
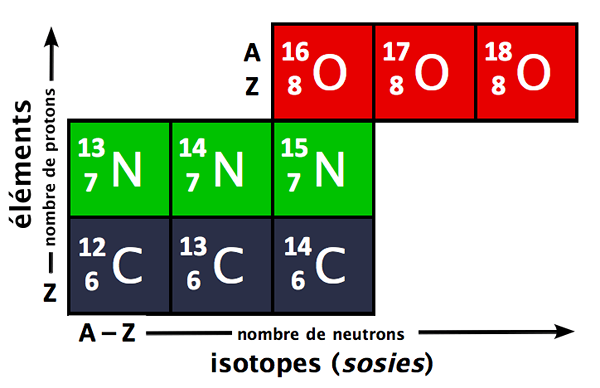
Gambar 1: Isotop dari berbagai elemen dapat digunakan untuk menemukan massa atom rata -rata mereka
Isotop setiap elemen terjadi secara alami dalam rasio yang berbeda. Persen kelimpahan isotop menunjukkan probabilitas menemukan bahwa isotop di alam karena unsur -unsur dapat ditemukan sebagai campuran isotop. Persentase kelimpahan dapat digunakan untuk menemukan massa atom elemen. Massa atom dapat ditemukan menggunakan persamaan berikut.
Massa atom rata -rata = ∑ (massa isotop x persen kelimpahan isotop)
Mari kita pertimbangkan contoh untuk memahami ini. Isotop klorin yang paling stabil dan alami adalah CL-35 (massa = 34.969 dan persen kelimpahan = 75.53%) dan CL-37 (massa = 36.966 dan persen kelimpahan = 24.47%). Kemudian,
Massa rata -rata klorin = ∑ (massa isotop x persen kelimpahan isotop)
= ∑ (34.969 x 75.53/100) + (36.966 x 24.47/100)
= 26.412 AMU + 9.045 Amu
= 35.46 Amu.
Apa itu kelimpahan relatif?
Kelimpahan relatif suatu unsur adalah ukuran terjadinya elemen relatif terhadap semua elemen lain di lingkungan. Ada tiga cara untuk menentukan kelimpahan relatif suatu elemen:
- Fraksi massa
- Fraksi mol
- Fraksi volume
Metode fraksi volume paling umum untuk elemen gas dalam campuran gas, i.E, atmosfer Bumi. Namun, sebagian besar ekspresi kelimpahan relatif adalah fraksi massa.

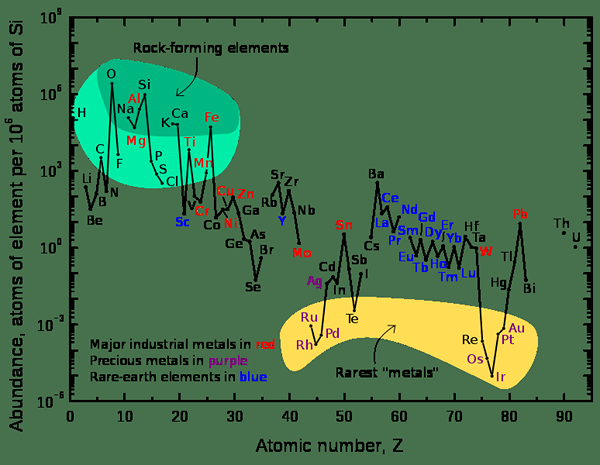
Gambar 2: Grafik yang menunjukkan kelimpahan relatif elemen di kerak atas bumi
Saat mempertimbangkan alam semesta, elemen kimia yang paling melimpah adalah hidrogen dan helium. Saat mempertimbangkan bumi, elemen yang paling umum adalah besi yang persentase massalnya adalah 32.1%. Elemen lain adalah oksigen (32.1%), silikon (15.1%), magnesium (13.9%), belerang (2.9%) dan elemen lainnya hadir dalam persentase jejak.
Apa kesamaan antara kelimpahan persen dan kelimpahan relatif?
- Kelimpahan persen dan kelimpahan relatif adalah nilai persentase.
- Kelimpahan persen dan kelimpahan relatif mengungkapkan persentase elemen kimia yang berbeda.
Apa perbedaan antara kelimpahan persen dan kelimpahan relatif?
Persen kelimpahan vs kelimpahan relatif | |
| Persen kelimpahan adalah jumlah persentase dari semua isotop yang terjadi secara alami dari suatu elemen. | Kelimpahan relatif dari suatu unsur adalah persentase dari terjadinya suatu unsur relatif terhadap semua elemen lain di lingkungan. |
| Perwakilan | |
| Persen kelimpahan memberikan kelimpahan isotop. | Kelimpahan relatif memberikan kelimpahan elemen kimia. |
Ringkasan -persen kelimpahan vs kelimpahan relatif
Persen kelimpahan dan kelimpahan relatif adalah dua istilah yang digunakan untuk memberikan kelimpahan isotop dan elemen kimia. Perbedaan utama antara kelimpahan persen dan kelimpahan relatif adalah bahwa persentase kelimpahan memberikan kelimpahan isotop sedangkan kelimpahan relatif memberikan kelimpahan unsur kimia.
Referensi:
1. “Massa atom rata -rata.”Rata -rata massa atom, [email dilindungi], tersedia di sini.
2. “Kelimpahan elemen kimia.”Wikipedia, Wikimedia Foundation, 25 Feb. 2018, tersedia di sini.
3. Simoes, Christian. “Kelimpahan elemen kimia.”Astrono, tersedia di sini.
Gambar milik:
1. "Isotop CNO" oleh Lucquessoy - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. "Kelimpahan Elemental" oleh Gordon B. Haxel, Sara Boore, dan Susan Mayfield dari USGS; Divektor oleh pengguna: Michbich - (domain publik) via commons wikimedia


