Perbedaan antara pH dan buffer
Itu perbedaan utama antara pH dan buffer adalah bahwa pH adalah skala logaritmik sedangkan buffer adalah larutan berair.
Kita dapat menggunakan pH cairan untuk menentukan apakah itu asam atau basa. Ini juga membantu dalam menentukan kapasitas buffering buffer. Larutan buffer mengandung campuran asam lemah dan basa konjugatnya, atau sebaliknya. Oleh karena itu, ia cenderung menahan perubahan pH larutan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ph
3. Apa itu buffer
4. Perbandingan berdampingan - pH vs buffer dalam bentuk tabel
5. Ringkasan
Apa itu ph?
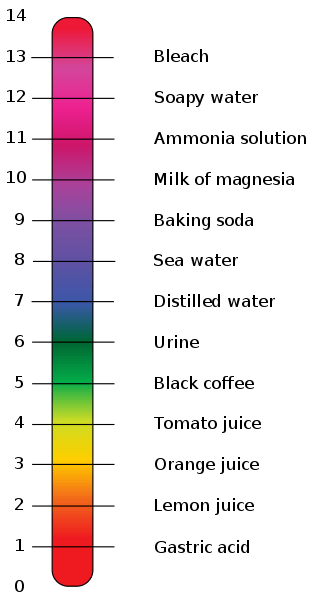
pH adalah skala logaritmik yang kami gunakan untuk menentukan keasaman atau kebasaan larutan berair. Ini adalah basa negatif 10 logaritma konsentrasi ion hidrogen yang diukur dalam satuan mol/L. Jika kita mengekspresikannya lebih tepat, kita harus menggunakan aktivitas ion hidrogen alih -alih konsentrasi. Skala pH memiliki angka dari 0 hingga 14. Solusi yang memiliki pH kurang dari 7 bersifat asam dan jika pH lebih tinggi dari 7, itu adalah solusi dasar. PH 7 menunjukkan solusi netral, i.e. air murni.

Gambar 01: pH komponen yang berbeda
Persamaan untuk penentuan pH adalah sebagai berikut:
pH = log10(AH+)
Di sini "A" adalah aktivitas ion hidrogen (h+). Nilai pH tergantung pada suhu larutan karena suhu dapat mengubah aktivitas spesies kimia. Oleh karena itu, saat memberikan pH larutan berair, kita harus menunjukkan suhu di mana pH diukur dengan tepat. Kami menggunakan skala pH untuk menentukan kualitas air, tanah, dll.
Apa itu buffer?
Buffer adalah larutan berair yang cenderung menahan perubahan pH. Larutan ini mengandung campuran asam lemah dan basa konjugatnya atau sebaliknya. PH larutan ini sedikit berubah setelah penambahan asam yang kuat atau basa yang kuat.
Asam lemah (atau basa) dan basa konjugatnya (atau asam konjugat) berada dalam kesetimbangan satu sama lain. Kemudian jika kita menambahkan asam kuat ke sistem ini, keseimbangan bergeser ke arah asam, dan membentuk lebih banyak asam menggunakan ion hidrogen yang dilepaskan dari asam kuat yang ditambahkan. Oleh karena itu, meskipun kami mengharapkan peningkatan ion hidrogen setelah penambahan asam kuat, itu tidak meningkat sebanyak itu. Demikian pula, jika kita menambahkan basis yang kuat, konsentrasi ion hidrogen berkurang kurang dari jumlah yang diharapkan untuk jumlah alkali yang ditambahkan. Kita dapat mengukur resistensi ini terhadap perubahan pH sebagai kapasitas buffer. Kapasitas buffer mengukur resistansi buffer terhadap perubahan pH pada penambahan OH- ion (basis). Kita dapat memberikannya dalam persamaan sebagai berikut:
β = dn/d (ph)
Di mana β adalah kapasitas buffer, DN adalah jumlah yang sangat kecil dari basis tambahan, dan D (pH) adalah perubahan pH infinitesimal yang dihasilkan.
Saat mempertimbangkan aplikasi buffer, solusi ini diperlukan untuk menjaga pH yang benar untuk aktivitas enzimatik dalam organisme. Selain itu, ini digunakan dalam industri dalam proses fermentasi, menetapkan kondisi yang benar untuk pewarna, dalam analisis kimia, mengkalibrasi meter pH, dll.
Apa perbedaan antara pH dan buffer?
pH adalah skala logaritmik yang kami gunakan untuk menentukan keasaman atau kebasaan larutan berair sedangkan, buffer adalah larutan berair yang cenderung menahan perubahan pH. Ini adalah perbedaan utama antara pH dan buffer. Selain itu, pH adalah skala yang sangat penting dalam kimia. Kita dapat mengukur pH solusi menggunakan pH meter atau melalui metode eksperimental. Selain itu, kami menggunakan skala pH untuk menentukan kualitas air, tanah, dll. Di sisi lain, penggunaan solusi buffer adalah untuk mempertahankan pH yang benar untuk aktivitas enzimatik, dalam proses fermentasi di industri, dalam menetapkan kondisi yang benar untuk pewarna, dalam analisis kimia, mengkalibrasi meter pH, dll. Kami mengukur kapasitas buffer buffer menggunakan analisis kimia.

Ringkasan -PH vs Buffer
pH adalah skala mendasar yang kami gunakan dalam kimia untuk mengukur keasaman r kebencian suatu larutan. Buffer adalah solusi kimia yang dapat menahan perubahan pH. Oleh karena itu, perbedaan antara pH dan buffer adalah bahwa pH adalah skala logaritmik sedangkan buffer adalah larutan berair.
Referensi:
1. “Ph.”Wikipedia, Wikimedia Foundation, 3 Agustus. 2018. Tersedia disini
2. “Solusi buffer.”Wikipedia, Wikimedia Foundation, 27 Juli 2018. Tersedia disini
Gambar milik:
1."Skala pH" oleh Edward Stevens - karya sendiri, (CC oleh 3.0) Via Commons Wikimedia


