Perbedaan antara pH dan poh
Perbedaan Utama - PH VS Poh
Istilah pH dan poh digunakan untuk mengekspresikan jumlah h+ dan oh- Ion hadir dalam larutan berair. Ekspresi ini diberikan sebagai nilai log minus konsentrasi zat terlarut. pH mengacu pada "potensi hidrogen". Dapat digunakan untuk menentukan apakah larutan bersifat asam, basa atau netral. Sebaliknya, POH adalah ukuran ion hidroksida (oh-) konsentrasi. Itu perbedaan utama antara pH dan poh adalah itu pH adalah ukuran ion hidrogen sedangkan POH adalah ukuran ion hidroksida.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ph
3. Apa itu poh
4. Hubungan antara pH dan poh
5. Perbandingan berdampingan - ph vs poh dalam bentuk tabel
6. Ringkasan
Apa itu ph?
pH adalah sosok yang mengekspresikan keasaman atau alkalinitas larutan pada skala logaritmik di mana 7 netral. Nilai lebih rendah dari 7 lebih asam sedangkan nilai lebih tinggi lebih basa. PH sama dengan −log10 C, di mana C adalah konsentrasi ion hidrogen dalam mol per liter.
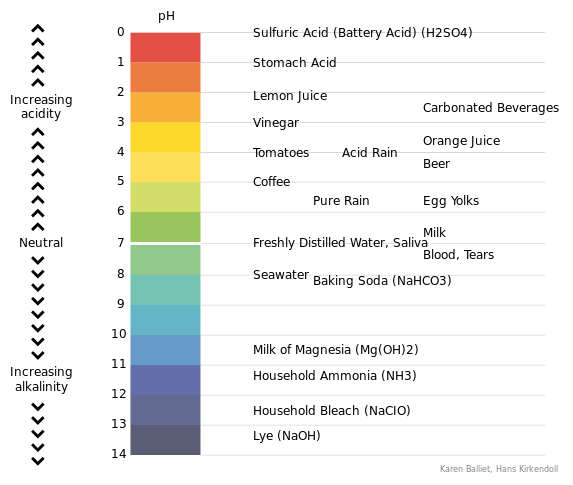
Skala pH berjalan dari 1 hingga 14. Nilai pH 1 hingga 6 diakui sebagai nilai pH asam. Nilai pH dari 8 hingga 14 diakui sebagai nilai pH dasar. PH 7 dianggap sebagai pH netral. Misalnya, asam kuat memiliki nilai pH di dekat pH = 1 sedangkan basa kuat memiliki nilai pH di dekat pH = 14. "P" dalam istilah ph mengacu pada logaritma negatif. Secara umum, logaritma negatif dari konser ion hidrogen (atau pH) digunakan alih -alih menggunakan konsentrasi ion hidrogen. Itu karena, sebagian besar waktu, konsentrasi ion hidrogen sangat rendah atau sangat besar, sehingga menggunakan pH membuatnya lebih mudah untuk bekerja dengan nilai kecil atau besar seperti itu.

Gambar 01: Skala pH
Dalam larutan air, molekul air terdisosiasi menjadi ion hidrogen dan ion hidroksida. Oleh karena itu, semua badan air alami memiliki nilai pH tertentu. PH sistem diberikan oleh persamaan berikut.
pH = − -log10 [H+]
Ada indikator yang dikenal sebagai indikator pH yang digunakan untuk menunjukkan titik akhir dari reaksi asam-basa. Indikator ini dapat mengubah warna media reaksi dengan perubahan pH. Misalnya, indikator fenolftalein memiliki warna merah muda dalam nilai pH dasar (sekitar pH = 10.0), tetapi tidak berwarna di sekitar pH = 8.3.
Apa itu poh?
POH adalah ukuran ion hidroksida (oh-) konsentrasi. Oleh karena itu, POH adalah ukuran alkalinitas larutan. "P" dalam istilah poh mengacu pada logaritma negatif. Oleh karena itu POH adalah logaritma negatif dari konsentrasi ion hidroksida dalam larutan.
pH = − -log10 [OH-]
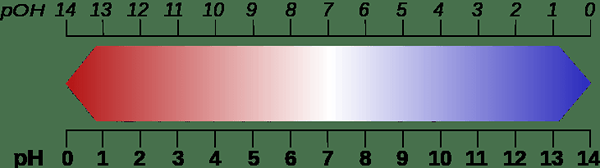
Gambar 02: Perbandingan skala pH dan POH
Karena istilah ini memberikan jumlah ion hidroksida yang ada dalam larutan berair, itu adalah ukuran kebasa (alkalinitas). Misalnya, nilai POH kurang dari POH = 7 (pada 25HaiC) adalah alkali. Kemudian, jika suatu solusi memiliki nilai POH di antara 1 hingga 6, solusinya lebih basa. POH = 7 dianggap netral. Tetapi nilai POH lebih tinggi dari 7 diakui sebagai kondisi asam.
Apa hubungan antara ph dan poh?
Untuk disosiasi air, konstanta disosiasi diberikan seperti di bawah ini.
H2O ⇆ h+ + OH-
Kw = [H+][OH-]
Di mana KW adalah konstanta disosiasi air, [h+] adalah konser ion hidrogen dan [oh-] adalah konsentrasi ion hidroksida. Tetapi untuk air murni, [h+] = [Oh-] = 1 × 10-7perempuan jalang. Kemudian, ketika logaritma negatif diambil untuk setiap istilah dalam persamaan di atas,
pkw = ph + poh
pkw = 7 + 7
PKW = 14
Maka jika saja pH diketahui, nilai POH dapat diperoleh bernyanyi di atas hubungan.
Namun, dalam skala pH dan POH, 7 adalah netral.
Apa perbedaan antara pH dan poh?
Ph vs Poh | |
| pH mengekspresikan keasaman atau alkalinitas larutan pada skala logaritmik di mana 7 netral. | POH adalah ukuran ion hidroksida (oh-) konsentrasi. POH = 7 dianggap netral |
| Ekspresi | |
| pH memberikan logaritma negatif konsentrasi ion hidrogen. | POH memberikan logaritma negatif konsentrasi ion hidroksida. |
| Nilai asam | |
| Skala pH memberikan nilai asam dari 1 hingga 6. | Skala POH memberikan nilai asam dari 8 hingga 14. |
| Nilai alkali | |
| Skala pH memberikan nilai dasar dari 8 hingga 14. | Skala POH memberikan nilai dasar dari 1 hingga 6. |
Ringkasan - Ph vs Poh
PH dan POH adalah dua istilah yang digunakan untuk mengekspresikan keasaman atau alkalinitas larutan. Perbedaan utama antara pH dan POH adalah bahwa pH adalah ukuran ion hidrogen sedangkan POH adalah ukuran ion hidroksida.
Unduh pdf ph vs poh
Anda dapat mengunduh versi PDF dari artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi PDF di sini: Perbedaan antara ph dan poh
Referensi:
1.Helmenstine, Anne Marie, D. “Definisi POH (Kimia)."Thoughtco, Jul. 24, 2017. Tersedia disini
2.Helmenstine, Anne Marie, D. “Cara menemukan POH dalam kimia."Thoughtco, Jan. 29, 2018. Tersedia disini
Gambar milik:
1.'Kekuatan Hidrogen (PH) Chart'by Hans Kirkendoll - Pekerjaan Sendiri, (Domain Publik) Via Commons Wikimedia
2.'Phscalenolang'by phscalenolang.PNG - Pekerjaan Sendiri (CC BY -SA 2.5) Via Commons Wikimedia


