Perbedaan antara PKA dan PKB
Perbedaan Utama - PKA vs PKB
PKA dan PKB adalah istilah umum dalam kimia yang dikenal sebagai konstanta disosiasi. PKA konstanta disosiasi asam, dan PKB adalah konstan disosiasi dasar. Istilah -istilah ini digunakan untuk memudahkan untuk bekerja dengan nilai yang sangat besar atau sangat kecil. "P" dalam istilah -istilah ini adalah singkatan dari "Negatif Logaritma". Itu perbedaan utama Antara PKA dan PKB adalah itu PKA adalah logaritma negatif KA sedangkan PKB adalah logaritma negatif dari KB.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu pKa
3. Apa itu PKB
4. Hubungan antara PKA dan PKB
5. Perbandingan berdampingan - PKA vs PKB dalam bentuk tabel
6. Ringkasan
Apa itu pKa?
PKA adalah logaritma negatif KA. Ka adalah konstanta disosiasi asam dari suatu larutan. Ini adalah pengukuran kuantitatif kekuatan asam dalam suatu larutan. Asam adalah senyawa kimia yang dapat melepaskan satu atau lebih ion hidrogen (proton) ke larutan. Jika disosiasi asam konstan; Ka lebih tinggi, itu berarti bahwa asam sepenuhnya (atau hampir sepenuhnya) terdisosiasi menjadi ion yang membentuk ion hidrogen. Kemudian, itu menunjukkan bahwa asam adalah asam yang kuat. Karena PKA adalah nilai logaritmik negatif KA, PKA adalah nilai yang lebih kecil untuk asam kuat.
pKa = -log10KA
Turunkan pka vlaue, semakin kuat asam. Demikian pula, lebih tinggi nilai pKa, semakin lemah asam. Dengan melihat nilai PKA dari asam yang berbeda, seseorang dapat membandingkan kekuatan asam relatif. Alih -alih menggunakan nilai KA, nilai PKA digunakan secara umum karena membuat lebih mudah untuk bekerja dengan jumlah yang sangat besar atau sangat kecil dengan tempat desimal kecil.

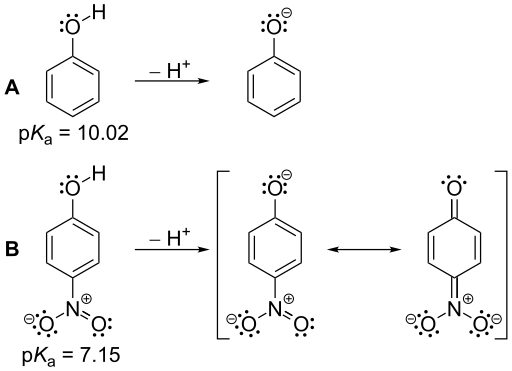
Gambar 01: Nilai PKA fenol dan nitrofenol: nitrofenol adalah asam yang lebih kuat dari fenol karena nilai PKA yang lebih kecil dibandingkan dengan nitrofenol.
Selain membandingkan kekuatan asam, nilai PKA juga digunakan untuk memilih buffer yang sesuai. Menurut persamaan Henderson-Hasselbalch, ada hubungan antara pH dan pKa suatu sistem.
pH = pkA + catatan10([A-]/[AH])
untuk disosiasi asam ha. Persamaan ini dapat ditulis ulang seperti di bawah ini.
KA/[H+] = [A-]/[AH]
Menurut persamaan ini, nilai PKA dan pH dari sistem yang sama sama ketika setengah dari asam telah dipisahkan. Karena kapasitas buffering suatu sistem adalah kemampuannya untuk mempertahankan pH larutan, buffer harus dipilih di mana PKA dan pH sangat dekat satu sama lain.
Apa itu PKB?
PKB adalah logaritma negatif dari KB. KB adalah konstanta disosiasi dasar. Ini digunakan untuk menentukan kekuatan basis secara kuantitatif. Saat alas dilarutkan dalam air, ia terdisosiasi menjadi ion yang membentuk solusi dasar. Basis yang kuat sepenuhnya dipisahkan. Basis yang lemah terdisosiasi sebagian.
pkb = -log10KB
"P" di PKB adalah singkatan dari "Negatif Logaritma". Karena sebagian besar nilai KB sangat besar atau sangat kecil, logaritma negatif dari nilai -nilai ini digunakan untuk membuatnya mudah ditangani. Oleh karena itu, nilai KB besar dapat ditandai dengan nilai PKB kecil dengan tempat desimal kecil.
Apa hubungan antara PKA dan PKB?
Hubungan antara KA dan KB diberikan seperti di bawah ini.
KW = ka.KB
Kemudian hubungan antara PKA dan PKB diberikan sebagai, (pada 25HaiC)
pKa + pkb = 14
Apa perbedaan antara PKA dan PKB?
PKA vs PKB | |
| PKA adalah logaritma negatif KA. | PKB adalah logaritma negatif dari KB. |
| Alam | |
| PKA diberikan untuk asam. | PKB diberikan untuk pangkalan. |
| Hubungan dengan konstanta disosiasi | |
| PKA terkait dengan konstanta disosiasi asam. | PKB terkait dengan konstanta disosiasi dasar. |
| Indikasi | |
| Lebih kecil nilai pKa, lebih kuat asam. | Lebih kecil nilai pkb, lebih lemah. |
Ringkasan - PKA vs PKB
PKA dan PKB digunakan untuk membandingkan kekuatan asam dan basa masing -masing. PKA diberikan untuk disosiasi asam. PKB diberikan untuk disosiasi basis. Perbedaan antara PKA dan PKB adalah bahwa PKA adalah logaritma negatif KA sedangkan PKB adalah logaritma negatif dari KB.
Unduh PDF PKA vs PKB
Anda dapat mengunduh versi PDF dari artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi PDF di sini: Perbedaan antara PKA dan PKB
Referensi:
1.Helmenstine, Anne Marie, D. “Definisi PKA dalam Kimia."Thoughtco, SEP. 15, 2017. Tersedia disini
2.Helmenstine, Anne Marie, D. “Hubungan PH dan PKA: Persamaan Henderson-Hasselbalch."Thoughtco, dec. 1, 2017. Tersedia disini
3.“Hubungan antara KA dan KB.”Khan Academy. Tersedia disini
Gambar milik:
1.'PKA Phenol vs Nitrophenol'by HBF878 - Pekerjaan Sendiri, (Domain Publik) Via Commons Wikimedia


