Perbedaan antara halogenoalkana sekunder primer dan tersier
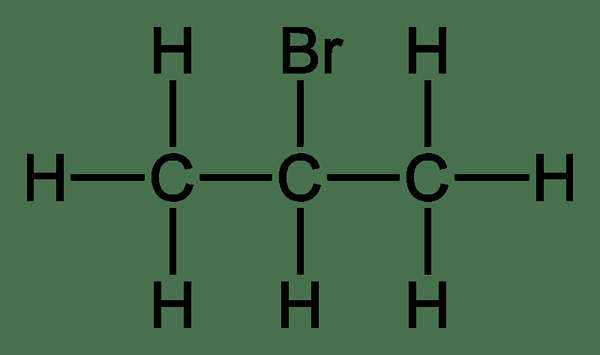
Itu perbedaan utama Antara halogenoalkana sekunder dan tersier adalah posisi atom karbon yang membawa atom halogen. Pada halogenoalkanes primer, atom karbon, yang membawa atom halogen, melekat hanya pada satu kelompok alkil. Tapi, di halogenoalkana sekunder, atom karbon ini melekat pada dua kelompok alkil. Sedangkan, di tersier halogenoalkanes, atom karbon ini melekat pada tiga kelompok alkil.
Halogenoalkana atau haloalkanes adalah alkana yang mengandung halogen. Halogen adalah elemen kimia kelompok 17 dari tabel periodik. Ini termasuk fluor (F), klorin (CL), bromin (BR), yodium (I), dan astatine (AT). Mungkin ada satu atau lebih halogen di haloalkane yang sama. Ada banyak aplikasi penting halogenoalkana sebagai penghambat api, alat pemadam kebakaran, refrigeran, propelan, dll. Namun, banyak haloalkane dianggap sebagai senyawa dan polutan beracun.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu halogenoalkanes
3. Apa itu halogenoalkana sekunder
4. Apa itu halogenoalkankan
5. Perbandingan berdampingan - halogenoalkankan sekunder primer vs tersier dalam bentuk tabel
6. Ringkasan
Apa itu halogenoalkanes?
Halogenoalkankan primer adalah senyawa organik yang memiliki atom karbon yang melekat pada satu kelompok alkil dan satu atom halogen. Oleh karena itu, struktur umum halogenoalkanes primer adalah R-CH2-X; R adalah kelompok alkil sedangkan x adalah halogen. Kita dapat menunjukkannya sebagai 10 haloalkanes. Contoh umum adalah halotan, yang berisi gugus etil sebagai kelompok R dan atom klorin sebagai kelompok X atau halogen. Namun, metil halida merupakan pengecualian untuk struktur halogenoalkanes primer ini karena mereka memiliki tiga atom hidrogen yang melekat pada atom karbon yang membawa atom halogen. Ini berarti, tidak ada gugus alkil yang melekat pada senyawa ini. Tetapi mereka dianggap sebagai haloalkanes utama.
Selain itu, jika kita mempertimbangkan reaktivitas halogenoalkanes primer, atom karbon, yang melekat pada atom halogen, adalah pusat reaktif karena halogen lebih elektronegatif daripada karbon; Dengan demikian, ia memberikan muatan positif parsial pada atom karbon dengan menarik elektron ikatan ke arah dirinya sendiri. Selanjutnya, senyawa ini dapat diserang oleh reagen nukleofilik yang mencari tuduhan positif. Jadi, ini mengarah pada reaksi substitusi nukleofilik. Dan, reaksi ini memiliki penghalang energi aktivasi yang tinggi. Ini adalah reaksi tipe SN2, dan kami menyebutkannya sebagai reaksi bimolekul.
Apa itu halogenoalkana sekunder?
Halogenoalkankan sekunder adalah senyawa organik yang memiliki atom karbon yang melekat pada dua kelompok alkil dan atom halogen. Struktur umum halogenoalkana sekunder adalah R2-C (-h) -x. Di sini, dua kelompok alkil (kelompok R) dapat menjadi kelompok yang serupa atau berbeda. Kita dapat menunjukkan senyawa ini sebagai 20 haloalkanes. Selain itu, halogenoalkana sekunder menjalani reaksi substitusi nukleofilik SN2. Oleh karena itu, mereka adalah reaksi bimolekul.

Gambar 02: 2-bromopropane
Reaktivitas haloalkane sekunder berada di antara reaktivitas halogenoalkana primer dan tersier karena adanya dua kelompok alkil menurunkan muatan positif pada atom karbon karena gugus alkil adalah spesies yang menandakan elektron.
Apa itu halogenoalkankan?
Tersier halogenoalkana adalah senyawa organik yang memiliki atom karbon yang melekat pada tiga gugus alkil (tidak ada atom hidrogen yang melekat langsung ke karbon ini) dan atom halogen. Struktur umum untuk haloalkane tersier adalah R3-C-X, di mana tiga kelompok R (kelompok alkil) dapat berupa kelompok yang sama atau berbeda. Kita dapat menunjukkan senyawa ini sebagai 30 haloalkanes. Selain itu, senyawa ini mengalami reaksi substitusi nukleofilik SN1. Tapi, mekanisme ini berbeda dari reaksi substitusi nukleofilik dari halogenoalkana primer dan sekunder.
Atom karbon yang membawa atom halogen memiliki muatan positif yang sangat rendah karena ada tiga kelompok pengembara elektron yang melekat pada atom karbon ini. Oleh karena itu, tidak memerlukan pembentukan perantara energi tinggi, dan nukleofil dapat secara langsung menyerang ion karbonium segera setelah terbentuk. Jadi, inilah mengapa kami menyebutnya reaksi unimolekul.
Apa perbedaan antara halogenoalkana sekunder primer dan tersier?
Halogenoalkanes memiliki tiga jenis tergantung pada strukturnya; halogenoalkankan primer, sekunder, dan tersier. Pada halogenoalkanes primer, atom karbon yang membawa atom halogen melekat hanya pada satu gugus alkil, dan pada halogenoalkana sekunder, atom karbon ini melekat pada dua gugus alkil, sedangkan pada halogenoalkanes tersier, atom karbon ini melekat pada tiga kelompok alkil tersier, atom karbon ini melekat pada tiga kelompok alkilllall, tersier, atom karbon ini melekat pada tiga gugus alkillall, tersier, atom karbon ini melekat pada tiga kelompok alkil alkil tersier, tersier, atom karbon ini melekat pada tiga gugus alkillall, tersier, atom karbon ini melekat pada tiga gugus alkillall tersier, tersier, atom karbon ini melekat pada tiga kelompok alkilllall. Jadi, ini adalah perbedaan utama antara halogenoalkana sekunder primer dan tersier.
Infografis berikut merangkum perbedaan antara halogenoalkana sekunder primer dan tersier.
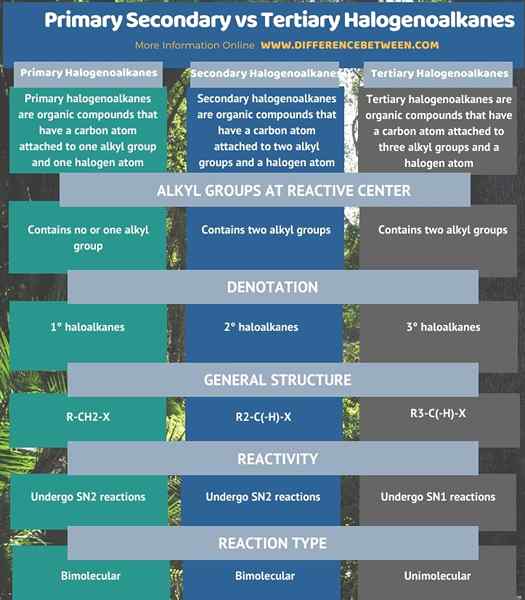
Ringkasan -VS sekunder primer. Tersier halogenoalkanes
Ada tiga jenis halogenoalkana tergantung pada strukturnya; halogenoalkankan primer, sekunder, dan tersier. Perbedaan utama antara halogenoalkana sekunder primer dan tersier adalah bahwa pada halogenoalkana primer, atom karbon, yang membawa atom halogen, melekat pada hanya satu kelompok alkil. Dan, dalam halogenoalkana sekunder, atom karbon ini melekat pada dua kelompok alkil. Sementara itu, dalam halogenoalkana tersier, atom karbon ini melekat pada tiga kelompok alkil.
Referensi:
1. “10.34 - Halogenoalkanes." Kimia organik, Tersedia disini.
Gambar milik:
1. “2-bromopropane-2d-flat” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia


