Perbedaan antara prototropi dan tautomerisme
Itu perbedaan utama antara prototropi dan tautomerisme adalah itu prototropi membahas dua bentuk molekul yang berbeda satu sama lain hanya dalam posisi proton tertentu sedangkan Tautomerisme membahas interkonversi dua isomer struktural melalui relokasi atom atau ikatan.
Prototropi adalah bentuk tautomerisme; itu adalah bentuk tautomerisme yang paling umum. Tautomerisme adalah konsep dalam kimia organik yang menggambarkan konversi satu isomer struktural menjadi isomer lain melalui relokasi atom atau ikatan. Jika relokasi terjadi dalam proton dalam molekul, maka kami menyebutnya prototropi. Oleh karena itu, jenis tautomerisme ini dikenal sebagai prototropik-tautomerisme.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu prototropi
3. Apa itu tautomerisme
4. Perbandingan Berdampingan - Prototropi vs Tautomerisme Dalam Bentuk Tabel
5. Ringkasan
Apa itu prototropi?
Prototropi adalah jenis tautomerisme di mana relokasi proton terjadi. Itu adalah bentuk tautomerisme yang paling umum. Oleh karena itu, ini juga dinamai prototi-tautomerisme. Kita dapat menganggapnya sebagai subset dari perilaku asam-basa. Tautomer prototropik adalah isomer yang menjalani protonasi isomerik antara molekul yang memiliki formula empiris yang sama dan total muatan. Asam dan basa dapat mengkatalisasi reaksi ini.
Ada dua jenis prototropik-tautomerisme; tautomerisme annular dan tautomerisme rantai cincin. Dalam tautomerisme annular, proton cenderung menempati dua atau lebih posisi sistem heterosiklik. Dalam tautomerisme rantai cincin, pergerakan proton disertai dengan perubahan dari struktur terbuka ke struktur cincin.
Apa itu tautomerisme?
Tautomerisme adalah konsep dalam kimia organik yang menggambarkan efek memiliki beberapa senyawa yang mampu melakukan interkonversi dengan memindahkan atom atau ikatan kimia. Jenis interkonversi ini paling umum pada asam amino dan asam nukleat. Proses interkonversi dikenal sebagai tautomerisasi, yang merupakan reaksi kimia. Dalam proses interkonversi ini, relokasi proton atau ikatan kimia berarti pertukaran atom hidrogen antara dua bentuk atom lainnya atau pembentukan cepat atau pecahnya ikatan tunggal atau rangkap.
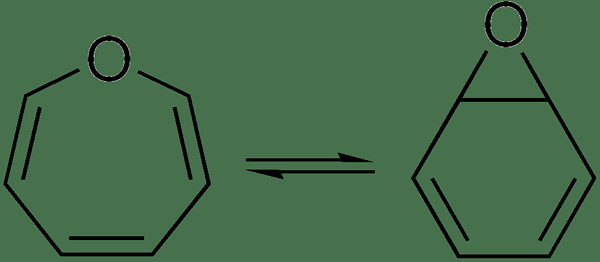
Jika tautomerisasi terjadi dengan relokasi proton, maka itu disebut prototropi. Jika tautomerisasi terjadi dengan relokasi ikatan tunggal atau rangkap, maka itu disebut valensi tautomerisme. Atom hidrogen membentuk ikatan kovalen dengan atom baru yang menerima atom hidrogen. Tautomer ada dalam keseimbangan satu sama lain. Mereka selalu ada dalam campuran dua bentuk senyawa karena mereka berusaha untuk menyiapkan bentuk tautomerik yang terpisah.

Gambar 01: Valensi Tautomerisme
Selama proses tautomerisasi, kerangka karbon molekul tidak berubah. Hanya posisi proton dan elektron yang diubah. Prosesnya adalah proses kimia intramolekul dari konversi satu bentuk tautomer menjadi bentuk yang berbeda. Contoh umum adalah tautomerisme keto-enol. Itu adalah reaksi asam atau yang dikatalisis basa. Biasanya, bentuk keto dari senyawa organik lebih stabil, tetapi di beberapa negara, bentuk enol lebih stabil daripada bentuk keto.
Apa perbedaan antara prototropi dan tautomerisme?
Prototropi dan tautomerisme adalah istilah yang terkait erat; prototropi adalah jenis tautomerisme. Perbedaan utama antara prototropi dan tautomerisme adalah bahwa prototropi membahas dua bentuk molekul yang berbeda satu sama lain hanya dalam posisi proton tertentu sedangkan tautomerisme membahas interkonversi dua isomer struktural melalui relokasi atom atau ikatan.
Di bawah ini adalah ringkasan perbedaan antara prototropi dan tautomerisme dalam bentuk tabel.
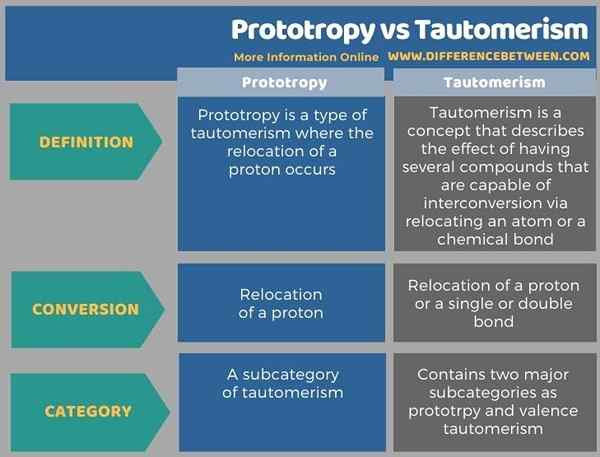
Ringkasan -Prototropi vs Tautomerisme
Prototropi dan tautomerisme adalah istilah yang terkait erat; prototropi adalah jenis tautomerisme. Perbedaan utama antara prototropi dan tautomerisme adalah bahwa prototropi membahas dua bentuk molekul yang berbeda satu sama lain hanya dalam posisi proton tertentu sedangkan tautomerisme membahas interkonversi dua isomer struktural melalui relokasi atom atau ikatan.
Referensi:
1. “Definisi untuk PrototropyPro · Totropy. Definisi, tersedia di sini.
Gambar milik:
1. “Oxepin -Benzene Oxide” oleh Edgar181 - Karya Sendiri (Domain Publik) Via Commons Wikimedia


