Perbedaan antara laju reaksi dan konstanta laju spesifik
Itu perbedaan utama antara laju reaksi dan konstanta laju spesifik adalah itu laju reaksi memberikan indikasi kecepatan di mana reaksi dikonversi menjadi produk sementara konstanta laju spesifik adalah konstanta proporsionalitas.
Ketika satu atau lebih reaktan dikonversi menjadi produk, mereka dapat melalui berbagai modifikasi dan perubahan energi. Ikatan kimia dalam reaktan rusak, dan ikatan baru dibentuk untuk menghasilkan produk yang sama sekali berbeda dari reaktan. Jenis modifikasi kimia ini dikenal sebagai reaksi kimia. Ada banyak variabel yang mengendalikan reaksi. Dengan mempelajari termodinamika dan kinetika, kita dapat menarik banyak kesimpulan tentang reaksi dan bagaimana kita dapat mengendalikannya. Termodinamika adalah studi tentang transformasi energi. Ini hanya berkaitan dengan energik dan posisi keseimbangan dalam suatu reaksi. Tidak ada yang bisa dikatakan tentang seberapa cepat keseimbangan tercapai. Pertanyaan ini adalah domain kinetika.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa laju reaksi
3. Apa konstanta laju spesifik
4. Perbandingan berdampingan - laju reaksi vs konstanta laju spesifik dalam bentuk tabel
5. Ringkasan
Apa laju reaksi?
Laju reaksi hanyalah indikasi kecepatan reaksi. Itu dapat dianggap sebagai parameter yang menentukan seberapa cepat atau seberapa lambat reaksinya. Secara alami, beberapa reaksi sangat lambat, jadi kita bahkan tidak bisa melihat reaksi terjadi kecuali kita mengamatinya untuk waktu yang sangat lama. Misalnya, pelapukan batu dengan proses kimia adalah reaksi yang sangat lambat yang terjadi selama bertahun -tahun. Sebaliknya, reaksi antara sepotong kalium dan air sangat cepat dan menghasilkan sejumlah besar panas; Ini dianggap sebagai reaksi yang kuat.
Pertimbangkan reaksi berikut di mana reaktan A dan B pergi ke produk C dan D.
A A + B B → C C + D D
Laju reaksi dapat diberikan dalam hal baik dari dua reaktan atau produk.
Rate = -(1/a) d [a]/dt = -(1/b) d [b]/dt = -(1/c) d [c]/dt = -(1/d) d [d ]/dt
A, B, C dan D adalah koefisien stoikiometrik dari reaktan dan produk. Untuk reaktan, persamaan laju ditulis dengan tanda minus karena produk menipis saat reaksi berlangsung. Namun, seiring meningkatnya produk, mereka diberi tanda -tanda positif.

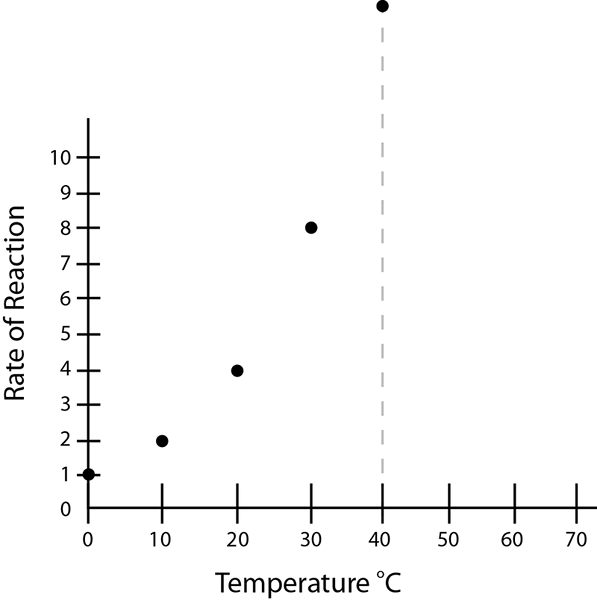
Gambar 01: Laju reaksi meningkat dengan meningkatnya suhu
Kinetika kimia adalah studi tentang laju reaksi dan ada banyak faktor yang mempengaruhi kecepatan reaksi. Faktor -faktor ini termasuk konsentrasi reaktan, katalis, suhu, efek pelarut, pH, kadang -kadang konsentrasi produk, dll. Faktor -faktor ini dapat dioptimalkan untuk memiliki laju reaksi maksimal atau dapat disesuaikan untuk memanipulasi laju reaksi yang diperlukan.
Apa konstanta laju spesifik?
Jika kita menulis persamaan laju sehubungan dengan reaktan A dalam reaksi yang diberikan di atas, itu adalah sebagai berikut.
R = -k [a] a [b] b
Dalam reaksi ini, k adalah konstanta laju. Ini dikenal sebagai konstanta laju spesifik ketika konsentrasi masing -masing reaktan adalah kesatuan; Saya.e. satu mol/dm3. Ini adalah konstanta proporsionalitas yang tergantung pada suhu. Laju dan konstanta laju spesifik suatu reaksi dapat ditemukan dengan percobaan.
Apa perbedaan antara laju reaksi dan konstanta laju spesifik?
Laju reaksi memberikan indikasi kecepatan di mana reaksi dikonversi menjadi produk sementara konstanta laju spesifik adalah konstanta proporsionalitas. Jadi, ini adalah perbedaan utama antara laju reaksi dan konstanta laju spesifik. Lebih penting lagi, konstanta laju spesifik adalah bagian dari laju reaksi. Konstanta laju spesifik hanya tidak dapat memberikan pernyataan yang valid tentang kecepatan reaksi.

Ringkasan -Laju reaksi vs konstanta laju spesifik
Perbedaan utama antara laju reaksi dan konstanta laju spesifik adalah bahwa laju reaksi memberikan indikasi kecepatan di mana reaksi dikonversi menjadi produk sementara konstanta laju spesifik adalah konstanta proporsionalitas.
Gambar milik:
1. “Kenaikan Laju Reaksi Dengan meningkatnya Suhu” oleh Brazosport College - Pekerjaan Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


