Perbedaan antara reaksi redoks dan nonredoks

Itu perbedaan utama Antara reaksi redoks dan nonredoks adalah itu Dalam reaksi redoks, keadaan oksidasi dari beberapa elemen kimia berubah dari satu keadaan ke keadaan lain sedangkan, dalam reaksi nonredox, keadaan oksidasi unsur kimia tidak berubah.
Reaksi redoks dan nonredoks adalah dua jenis utama reaksi kimia. Kedua kelompok ini berbeda satu sama lain tergantung pada perubahan yang terjadi pada keadaan oksidasi elemen kimia dari mana reaktan terbuat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu reaksi redoks
3. Apa reaksi nonredox
4. Perbandingan berdampingan - reaksi redoks vs nonredox dalam bentuk tabel
5. Ringkasan
Apa itu reaksi redoks?
Reaksi redoks adalah jenis reaksi kimia di mana oksidasi dan reduksi setengah reaksi terjadi secara bersamaan. Dalam reaksi ini, kami menganggap oksidasi dan pengurangan sebagai proses pelengkap. Di sini, oksidasi adalah hilangnya elektron atau peningkatan keadaan oksidasi sementara reduksi adalah gain elektron atau penurunan keadaan oksidasi. Istilah "redoks" adalah bentuk pendek dari proses reduksi-oksidasi.
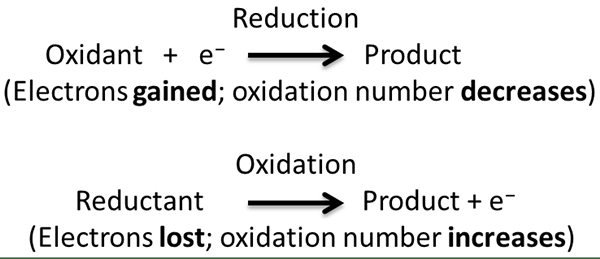
Selama reaksi redoks, senyawa kimia/reaktan yang mengalami reduksi disebut zat pengoksidasi sementara senyawa yang mengalami oksidasi disebut agen pereduksi. Ini karena zat pengoksidasi menyebabkan senyawa lain menjalani oksidasi dan sebaliknya.
Dalam reaksi redoks, yang sebenarnya terjadi adalah transfer elektron antara dua reaktan melalui setengah reaksi. Kami dapat dengan mudah mengidentifikasi transfer elektron ini dengan mengamati keadaan oksidasi elemen kimia. Selama transfer elektron, keadaan oksidasi meningkat jika elektron hilang karena meninggalkan proton yang tidak seimbang dalam atom, dan keadaan oksidasi berkurang ketika elektron diperoleh karena elektron adalah muatan negatif dari partikel subatomik. Ada berbagai jenis reaksi redoks, seperti reaksi dekomposisi, reaksi kombinasi, reaksi perpindahan, dan reaksi disproporsional.
Apa reaksi nonredox?
Reaksi nnonredox adalah reaksi kimia di mana tidak ada perubahan dalam keadaan oksidasi elemen kimia terjadi. Oleh karena itu, reaksi kimia ini tidak memiliki reaksi setengah untuk oksidasi dan reduksi seperti pada reaksi redoks. Dengan kata lain, ada transfer elektron yang terjadi selama perkembangan reaksi kimia.

Gambar 02: NaOH dan reaksi netralisasi HCl
Contoh umum reaksi non-redoks termasuk reaksi netralisasi dan reaksi perpindahan ganda.
Apa perbedaan antara reaksi redoks dan nonredox?
Reaksi redoks dan nonredoks adalah dua jenis reaksi kimia yang berbeda. Perbedaan utama antara reaksi redoks dan nonredoks adalah bahwa dalam reaksi redoks, keadaan oksidasi beberapa elemen kimia berubah dari satu keadaan ke keadaan lain sedangkan, dalam reaksi nonredoks, keadaan oksidasi unsur kimia tidak berubah. Selain itu, reaksi redoks memiliki oksidasi setengah reaksi dan pengurangan setengah reaksi sementara tidak ada reaksi setengah tertentu yang dapat diamati dalam reaksi nonredox. Reaksi dekomposisi, reaksi perpindahan, reaksi disproporsional, dll. adalah contoh reaksi redoks saat reaksi netralisasi, reaksi perpindahan ganda, dll. adalah contoh reaksi nonredox.
Infografis berikut menabulasi perbedaan antara reaksi redoks dan nonredox.

Ringkasan -Reaksi Redoks vs Nonredox
Reaksi redoks dan nonredoks adalah dua jenis reaksi kimia yang berbeda. Perbedaan utama antara reaksi redoks dan nonredoks adalah bahwa dalam reaksi redoks, keadaan oksidasi beberapa elemen kimia berubah dari satu keadaan ke keadaan lain sedangkan, dalam reaksi nonredoks, keadaan oksidasi unsur kimia tidak berubah.
Referensi:
1. “Reaksi reduksi oksidasi." Libreteks Kimia, Libretexts, 15 Agustus. 2020, tersedia di sini.
Gambar milik:
1. "Redox Bagi" oleh Cameron Garnham - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. “Reaksi netralisasi antara natrium hidroksida dan asam hidroklorat” oleh Bluescan SV.Wiki - Pekerjaan Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


