Perbedaan antara efek perisai dan skrining
Perbedaan utama - perisai vs Penyaringan Memengaruhi
Efek pelindung adalah pengurangan muatan nuklir efektif pada awan elektron, karena perbedaan gaya tarik elektron dalam nukleus. Dengan kata lain, ini adalah pengurangan daya tarik antara nukleus atom dan elektron terluar karena adanya elektron shell dalam. Istilah efek perisai dan efek skrining berarti sama. Tidak ada perbedaan antara efek perisai dan efek skrining.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa efek perisai
3. Apa itu Efek Pemutaran
4. Efek perisai vs skrining
5. Ringkasan
Apa efek perisai?
Efek perisai adalah pengurangan muatan nuklir efektif pada awan elektron, karena perbedaan gaya tarik antara elektron dan nukleus. Istilah ini menggambarkan gaya tarik antara elektron dan inti atom yang memiliki lebih dari satu elektron. Itu juga disebut pelindung atom.
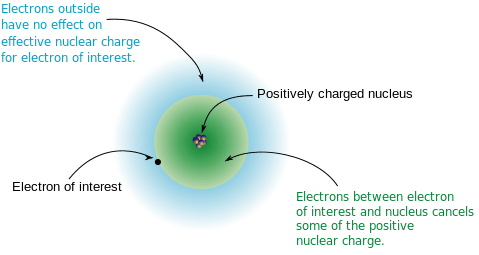
Efek perisai memberikan pengurangan daya tarik antara nukleus atom dan elektron terluar dalam atom yang mengandung banyak elektron. Muatan nuklir yang efektif adalah muatan positif bersih yang dialami oleh elektron di cangkang elektron terluar dari atom (elektron valensi). Ketika ada banyak elektron shell dalam yang ada, inti atom memiliki lebih sedikit ketertarikan dari nukleus atom. Itu karena inti atom dilindungi oleh elektron. Lebih tinggi jumlah elektron dalam, lebih besar efek perisai. Urutan meningkatkan efek perisai adalah sebagai berikut.
S orbital> p orbital> d orbital> f orbital
Ada tren periodik efek perisai. Atom hidrogen adalah atom terkecil di mana satu elektron hadir. Tidak ada elektron pelindung, oleh karena itu muatan nuklir yang efektif pada elektron ini tidak berkurang. Oleh karena itu, tidak ada efek perisai. Tetapi saat bergerak melintasi suatu periode (dari kiri ke kanan) dalam tabel periodik, jumlah elektron yang ada dalam atom meningkat. Maka efek perisai juga meningkat.
Energi ionisasi atom ditentukan terutama oleh efek perisai. Energi ionisasi adalah jumlah energi yang dibutuhkan untuk menghilangkan elektron terluar dari atom atau ion. Jika efek perisai tinggi, maka elektron terluar dari atom itu kurang tertarik pada nukleus atom, dengan kata lain, elektron terluar mudah dihilangkan. Oleh karena itu, lebih besar efek perisai, lebih rendah energi ionisasi.

Gambar 01: Efek pelindung pada elektron
Namun, ada beberapa pengecualian dari nilai energi ionisasi saat bergerak melintasi periode tabel periodik. Misalnya, energi ionisasi Mg (magnesium) lebih tinggi dari Al (aluminium). Tetapi jumlah elektron di AL lebih tinggi dari mg. Ini terjadi karena atom al memiliki elektron terluar dalam orbital 3p dan elektron ini tidak berpasangan. Elektron ini dilindungi oleh dua elektron 3S. Dalam mg elektron terluar adalah dua elektron 3S yang dipasangkan dalam orbital yang sama. Oleh karena itu, muatan nuklir yang efektif pada elektron valensi AL kurang dari mg. Oleh karena itu mudah untuk dihilangkan dari AL Atom, menghasilkan energi ionisasi yang lebih sedikit dibandingkan dengan MG.
Apa itu Efek Pemutaran?
Efek skrining juga dikenal sebagai efek perisai. Ini adalah efek pengurangan tarik antara nukleus atom dan elektron terluar karena adanya elektron kulit dalam. Itu terjadi karena elektron shell bagian dalam melindungi nukleus atom.
Apa perbedaan antara efek perisai dan skrining
- Efek perisai adalah pengurangan muatan nuklir efektif pada awan elektron, karena perbedaan gaya tarik antara elektron dan nukleus. Efek perisai juga dikenal sebagai efek skrining. Oleh karena itu, tidak ada perbedaan antara kedua istilah ini. Mereka terutama berarti hal yang sama.
Ringkasan
Efek pelindung atau efek skrining adalah pengurangan daya tarik antara nukleus atom dan elektron terluar karena adanya elektron cangkang bagian dalam. Efek pelindung menyebabkan pengurangan muatan nuklir yang efektif pada elektron. Elektron valensi dipengaruhi oleh efek ini. Tidak ada perbedaan antara istilah efek perisai dan efek yang melayang.
Referensi:
1.“6.17: Perisai Elektron."Kimia Libretexts, Libretexts, 23 Agustus. 2017. Tersedia disini
2.“Efek perisai.Efek Perisai | Definisi | Tren | Tutorvista. Tersedia disini
3.“Efek perisai.”Wikipedia, Wikimedia Foundation, 5 Mar. 2018. Tersedia disini
Gambar milik:
1.'Diagram Biaya Nuklir Efektif Frozenman (Domain Publik) melalui Commons Wikimedia


