Perbedaan antara SP SP2 dan SP3
Itu perbedaan utama antara SP SP2 dan SP3 adalah bahwa Orbital hibrida SP memiliki karakteristik orbital 50% s dan orbital hibrida SP2 memiliki karakteristik orbital 33% s sedangkan orbital hibrida SP3 memiliki karakteristik orbital 25% s.
Istilah SP, SP2 dan SP3, merujuk pada hibridisasi orbital yang berbeda yang mengarah ke orbital hibrida. Orbital adalah daerah hipotetis di sekitar inti atom, yang mengandung elektron atom itu. Orbital ini dapat menjalani hibridisasi untuk membentuk orbital hibrida baru yang dapat membentuk ikatan kimia kovalen. Ada beberapa bentuk hibridisasi menurut orbital atom yang mengambil bagian dalam proses hibridisasi. SP, SP2 dan SP3 adalah beberapa hibridisasi umum yang melibatkan dalam orbital S dan P dari sebuah atom.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu sp
3. Apa itu sp2
4. Apa itu sp3
5. Perbandingan berdampingan - SP vs SP2 vs SP3 dalam bentuk tabel
6. Ringkasan
Apa itu sp?
Hibridisasi SP adalah bentuk hibridisasi paling sederhana di mana orbital yang tumpang tindih dengan orbital P untuk membentuk dua orbital SP baru. Shell elektron berisi tiga orbital P. Dalam hibridisasi ini, salah satu dari tiga orbital P ini bercampur dengan orbital atom yang sama. Oleh karena itu, ada dua orbital P yang tidak dihitridisasi yang tersisa di atom-atom ini.

Gambar 01: Susunan spasial orbital hibrida SP
Rasio pencampuran dua orbital atom adalah 1: 1 (s: p). Oleh karena itu orbital hibrida baru memiliki 50% karakteristik orbital S dan 50% dari karakteristik orbital P. Pencampuran orbital atom S dan P ini membentuk dua orbital hibrida baru. Kedua orbital ini mengatur pengaturan spasial linier; mengarahkan setiap orbital atom ke arah yang berlawanan. Pengaturan ini menghasilkan ketegangan paling sedikit antara kedua orbital. Oleh karena itu, sudut ikatan akan menjadi 180◦.
Apa itu sp2?
Hibridisasi SP2 adalah bentuk hibridisasi orbital di mana satu s orbital tumpang tindih dengan dua orbital P untuk membentuk tiga orbital hibrida baru. Karena ada tiga orbital atom P dalam atom, hibridisasi ini meninggalkan satu orbital P yang tidak dihitamkan. Tidak seperti pada hibridisasi SP, dalam bentuk hibridisasi ini, karakteristik S setiap orbital hibrida SP2 adalah 33% hadir sedangkan karakteristik orbital P adalah 66%.
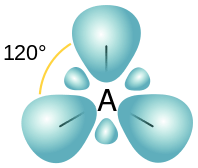
Gambar 02: Susunan spasial orbital SP2
Namun, ini hanya perkiraan nilai karena rasio antara tiga orbital atom yang terlibat dalam hibridisasi ini adalah S: P = 1: 2.
Maka karakteristik S sama dengan 100/3 = 33.33%
Dan karakteristik p sama (100/3) x 2 = 66.66%
Tiga orbital hibrida baru ini mendapatkan pengaturan spasial planar trigonal untuk meminimalkan ketegangan antara orbital. Juga, sudut ikatan antara orbital ini adalah 120◦.
Apa itu sp3?
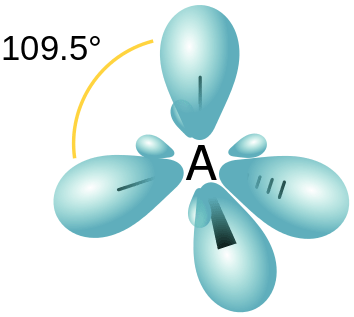
Hibridisasi SP3 adalah bentuk hibridisasi orbital di mana satu orbital tumpang tindih dengan tiga orbital P. Oleh karena itu, tidak ada orbital P yang tidak dihit karena semua orbital P terlibat dalam proses hibridisasi.

Gambar 03: Susunan spasial orbital hibrida SP3
Oleh karena itu, ini menghasilkan 4 orbital hibrida baru. Karena rasio antara orbital S dan P adalah 1: 3, karakteristik S dari masing -masing orbital hibrida adalah 25% sedangkan karakteristik orbital P adalah 75%. Orbital hibrida baru ini mengatur pengaturan tetrahedral dengan 109.Sudut ikatan 5◦.
Apa perbedaan antara SP SP2 dan SP3?
Hibridisasi SP adalah bentuk hibridisasi paling sederhana di mana orbital yang tumpang tindih dengan orbital P untuk membentuk dua orbital SP baru, dan hibridisasi SP2 adalah bentuk hibridisasi orbital di mana satu s orbital tumpang tindih dengan dua orbital P untuk membentuk tiga orbital hibrida baru baru yang tumpang tindih dengan dua P untuk membentuk tiga orbital hibrida baru S baru yang tumpang tindih dengan dua p untuk membentuk tiga orbital hibrida baru S baru tumpang tindih dengan dua p untuk membentuk tiga orbital hibrida baru S baru yang tumpang tindih dengan dua p untuk membentuk tiga orbital hibrida baru S yang baru S. Sedangkan hibridisasi SP3 adalah bentuk hibridisasi orbital di mana satu s orbital tumpang tindih dengan tiga orbital P. Ini adalah perbedaan mendasar antara orbital hibrida SP SP2 dan SP3. Selain itu, masing -masing orbital hibrida baru yang terbentuk dalam tiga bentuk hibridisasi ini memiliki karakteristik orbital yang berbeda karena orbital S bercampur dengan jumlah orbital P yang berbeda. Oleh karena itu mereka juga memiliki karakteristik orbital P yang berbeda.
Namun, kita dapat menekankan perbedaan utama antara hibridisasi SP2 dan SP3 sesuai dengan karakteristik S orbital hibrida ini; Orbital hibrida SP memiliki karakteristik orbital 50% s, dan orbital hibrida SP2 memiliki karakteristik orbital 33% s sedangkan orbital hibrida SP3 memiliki karakteristik orbital 25% s. Selain itu, setiap hibridisasi menyisakan jumlah orbital yang tidak dihitridisasi yang berbeda. Misalnya, hibridisasi SP hanya melibatkan 1 p orbital atom. Dengan demikian, ia meninggalkan dua orbital atom P yang tidak dihitridisasi.
Infografis di bawah ini menunjukkan perbandingan berdampingan dengan perbedaan antara hibridisasi SP SP2 dan SP3.

Ringkasan -SP SP2 vs SP3
Hibridisasi adalah proses di mana orbital atom bercampur satu sama lain untuk membentuk orbital hibrida baru yang dapat menjalani ikatan kimia kovalen. Bentuk hibridisasi orbital atom paling sederhana adalah hibridisasi SP, SP2 dan SP3. Perbedaan utama antara SP SP2 dan SP3 adalah bahwa orbital hibrida SP memiliki karakteristik orbital 50% s dan orbital hibrida SP2 memiliki karakteristik orbital 33% s sedangkan orbital hibrida SP3 memiliki karakteristik orbital 25% s sm.
Referensi:
1. “Hibridisasi Orbital.”Wikipedia, Wikimedia Foundation, 13 September. 2018. Tersedia disini
2. Libretexts. "Hibridisasi.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
Gambar milik:
1."AE2H" oleh JFMelero - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia
2."AE3H" oleh JFMelero - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia
3."AE4H" oleh JFMelero - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


