Perbedaan antara spin-orbit coupling dan efek Russell-Saunders
Itu perbedaan utama Antara kopling spin-orbit dan efek Russell-Saunders adalah itu Kopling spin-orbit menggambarkan interaksi antara putaran partikel dengan gerakan orbitnya sedangkan efek kopling Russell-Saunders menggambarkan kopling momen sudut orbital dari beberapa elektron.
Istilah kopling dalam kimia analitik terutama mengacu pada interaksi antara komponen kimia seperti orbital dan elektron. Kopling spin-orbit dan efek Russel-Saunders adalah dua bentuk kopling tersebut. Secara umum, efek Russell-Saunders dinamai sebagai kopling LS dan mengacu pada interaksi antara momen sudut orbital L dan S.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu spin-orbit coupling
3. Apa efek Russell-Saunders
4. Perbandingan Berdampingan-Kopling Spin-Orbit vs Russell-Saunders Efek Dalam Bentuk Tabel
5. Ringkasan
Apa itu spin-orbit coupling?
Kopling spin-orbit adalah jenis interaksi antara putaran partikel dan gerakannya di dalam suatu potensi. Ini adalah jenis interaksi relativistik. Contoh umum dalam kimia untuk kopling spin-orbit adalah interaksi spin-orbit yang mengarah pada pergeseran tingkat energi atom elektron karena interaksi elektromagnetik antara dipol magnetik elektron dan gerakan orbitnya, bersama dengan elektromagnetik bidang inti atom yang bermuatan positif. Kita dapat mendeteksi kopling orbit spin sebagai pemisahan garis spektral. Tampaknya sebagai efek zeeman yang dihasilkan oleh dua efek relativistik: medan magnet yang terlihat terlihat dari perspektif elektron dan momen magnetik elektron.
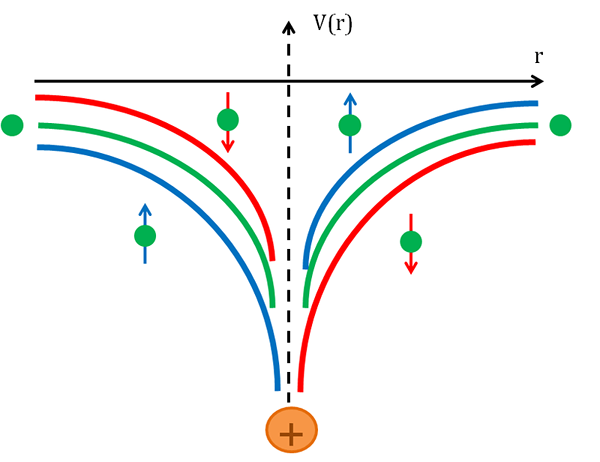
Gambar 01: Potensi kopling spin-orbit
Fenomena kopling spin-orbit penting di bidang spintonics untuk melakukan elektron di semikonduktor dan bahan lainnya. Selain itu, kopling spin-orbit adalah penyebab anisotropi magnetokristalin dan efek spin-telak. Kita dapat mengamati kopling orbit spin dalam tingkat energi atom dan juga padat.
Apa efek Russell-Saunders?
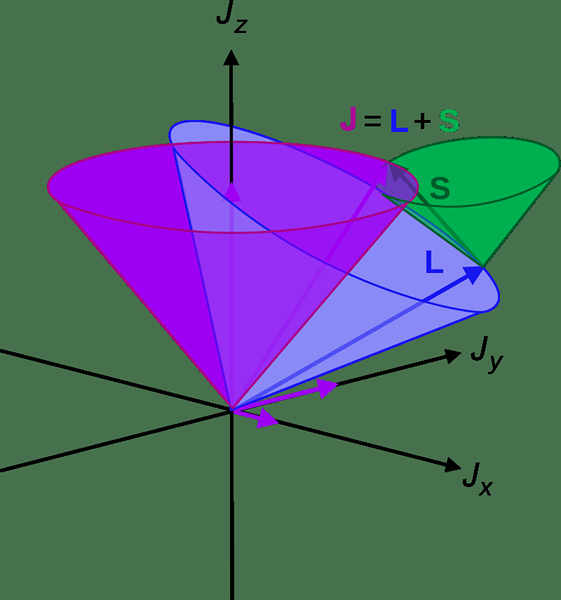
Efek Russell-Saunders adalah jenis efek kopling dalam kimia analitik di mana semua momen sudut beberapa elektron sangat digabungkan bersama, membentuk momentum sudut orbital elektronik total atom. Fenomena ini biasanya bernama LS Coupling karena L adalah singkatan dari momentum sudut orbital dan S adalah singkatan dari momentum sudut putaran. Ini adalah salah satu skema kopling paling sederhana dalam kimia.

Gambar 02: Kopling LS
Kopling Russell-Saunders dapat diamati terutama dalam atom cahaya yang biasanya memiliki nilai yang kurang dari 30 untuk angka atom. Dalam atom -atom kecil ini, spin elektron berinteraksi satu sama lain, membentuk momentum sudut putaran total (s). Proses yang sama terjadi dengan orbital elektron (L) membentuk momentum sudut orbital total (L). Interaksi antara momen L dan S ini bernama LS Coupling atau Efek Russell-Saunders. Namun, di medan magnet yang besar, kita dapat mengamati dua momenta decoupling ini. Oleh karena itu, fenomena ini cocok untuk sistem dengan medan magnet eksternal kecil dan lemah.
Apa perbedaan antara spin-orbit coupling dan efek Russell-Saunders?
Istilah kopling dalam kimia analitik terutama mengacu pada interaksi antara komponen kimia seperti orbital dan elektron. Perbedaan utama antara kopling spin-orbit dan efek Russell-Saunders adalah bahwa kopling spin-orbit menggambarkan interaksi antara putaran partikel dengan gerakan orbitornya sedangkan efek kopling Russell-Saunders menggambarkan kopling momen sudut orbital dari beberapa elektron.
Di bawah ini adalah ringkasan perbedaan antara kopling spin-orbit dan efek Russell-Saunders dalam bentuk tabel.
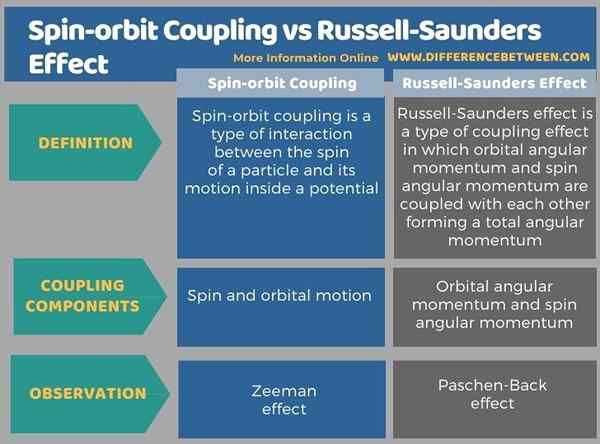
Ringkasan-Efek Spin-Orbit Coupling vs Russell-Saunders
Istilah kopling dalam kimia analitik terutama mengacu pada interaksi antara komponen kimia seperti orbital dan elektron. Perbedaan utama antara kopling orbit spin dan efek Russell-Saunders adalah bahwa kopling orbit spin menggambarkan interaksi antara putaran partikel dengan gerakan orbitnya sedangkan efek kopling Russell-Saunders menggambarkan kopling momen sudut orbital dari beberapa elektron.
Referensi:
1. “Kopling spin-orbit."Kimia Libretexts, Libretexts, 15 Agustus. 2020, tersedia di sini.
Gambar milik:
1. “Spin-Orbit Coupling Potential” oleh Food95-Karya Sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. "LS Coupling" oleh Maschen - karya sendiri (domain publik) melalui Commons Wikimedia


