Perbedaan antara asam sulfat dan asam belerang
Perbedaan utama - Belerang Asam vs. Asam belerang
Asam sulfat (h2JADI4) dan asam belerang (h2JADI3) adalah dua asam anorganik yang mengandung sulfur, hidrogen, dan oksigen sebagai elemen. Itu perbedaan utama Antara asam sulfat dan asam belerang berada dalam jumlah oksidasi belerang. Selain itu, ketika kami membandingkan dua asam dalam hal keasaman, Asam sulfat lebih asam daripada asam belerang. Dengan kata lain, asam sulfat adalah asam yang sangat kuat, dan asam belerang relatif lemah.
Apa itu asam sulfat?
Asam sulfat adalah a asam mineral diprotik yang sangat kuat Itu benar -benar larut dengan air dalam proporsi apa pun. Melarutkan asam sulfat dalam air adalah reaksi eksotermik. Ini adalah cairan yang korosif dan berbahaya dan menyebabkan begitu banyak cedera seperti luka bakar asam pada kulit atau mata. Ini termasuk efek jangka pendek dan jangka panjang tergantung pada konsentrasi asam dan waktu kontak. Asam sulfat sangat korosif karena beberapa faktor; Keasaman, kemampuan pengoksidasi, dehidrasi yang disebabkan oleh larutan terkonsentrasi dan panas yang dilepaskan oleh reaksi eksotermik.

Apa itu asam belerang?
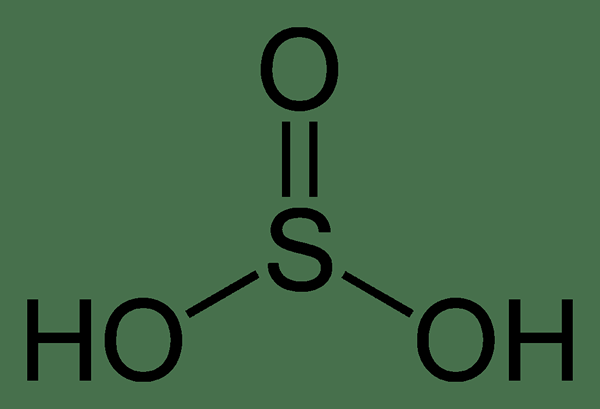
Asam belerang memiliki formula kimia h2JADI3, di mana jumlah oksidasi belerang sama dengan +4. Itu adalah asam yang jernih, tidak berwarna, lemah dan tidak stabil. Ini memiliki bau belerang terbakar yang menyengat. Itu terbentuk ketika sulfur dioksida larut dalam air dan bentuk anhidrat murni asam belerang tidak pernah terisolasi atau terdeteksi. Asam belerang membusuk dan terdisosiasi menjadi konstituen kimianya dengan cepat; karena secara termodinamik tidak stabil. Reaksi dekomposisi adalah,
H2JADI3 (aq) → H2HAI(l) + JADI2 (g)
Apa perbedaan antara asam sulfat dan asam belerang?
Struktur dan Formula Kimia:
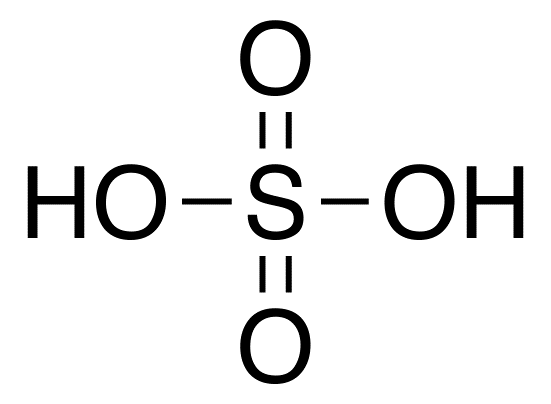
Asam sulfat: Formula kimia asam sulfat adalah H2JADI4 dimana jumlah oksidasi belerang adalah +6. Struktur geometris molekul ini adalah tetrahedral.
Asam belerang: Formula kimia asam sulfat adalah H2JADI3 dimana jumlah oksidasi belerang adalah +4. Struktur geometris molekul ini adalah piramidal trigonal.
Keasaman:
Asam sulfat: Sulfat adalah salah satu asam terkuat, dan itu adalah asam diprotik. Konstanta disosiasi asam asam sulfat adalah; K1 = 2.4 × 106(asam kuat) dan k2 = 1.0 × 10−2.
Asam belerang: Keasaman asam belerang pada skala pH sama dengan 1.5. Itu tidak dianggap sebagai asam yang sangat kuat, tetapi itu bukan asam yang terlalu lemah juga.
Properti:
Asam sulfat: Asam sulfat memiliki karakteristik pengoksidasi dan pengurangan selain sifat asamnya. Oleh karena itu, ia bereaksi dengan logam dan non-logam; itu bereaksi sebagai asam lain dengan logam yang menghasilkan gas hidrogen dan garam logam yang relevan.
Reaksi dengan logam:
Fe (S) + H2JADI4 (aq) → h2 (g) + feso4 (aq)
Cu + 2 jam2JADI4 → Jadi2 + 2 h2O + Jadi42− + Cu2+
Reaksi dengan non-logam:
C + 2 H2JADI4 → co2 + 2 Jadi2 + 2 h2HAI
S + 2 H2JADI4 → 3 Jadi2 + 2 h2HAI
Asam belerang: Asam belerang tidak ada sebagai larutan dalam asam sulfat seperti anhidrat seperti asam sulfat. Namun, ada bukti bahwa molekul belerang ada dalam fase gas. Tidak seperti h2JADI4, Asam belerang menunjukkan jumlah reaksi kimia yang sangat terbatas.
Caco3(S) + H2JADI3(aq) → co2(G) + H2HAI(l) + Caso3(aq)
Penggunaan:
Asam sulfat: Asam sulfat banyak digunakan di seluruh dunia dalam berbagai industri. Misalnya, ini digunakan untuk menghasilkan pupuk, bahan peledak, kertas, deterjen, pewarna dan bahan pewarnaan. Selain itu, sangat penting dalam sintesis kimia, perawatan permukaan, minyak bumi, dan industri tekstil.
Asam belerang: Asam belerang digunakan sebagai zat pereduksi yang sangat kuat. Ini memiliki beberapa sifat pemutihan dan digunakan sebagai agen pemutihan.
Gambar milik:
1. Struktur Kimia Asam Sulfat oleh DMacks (Pekerjaan Sendiri) [Domain Publik], melalui Wikimedia Commons
2. Sulfurous-acid-2d oleh Benjah-BMM27 (karya sendiri) [domain publik], melalui Wikimedia Commons


