Perbedaan antara titrasi asam-basa dan titrasi redoks
Perbedaan Utama -Titrasi Basa Asam VS. Titrasi redoks
Secara umum, titrasi digunakan untuk menentukan konsentrasi solusi yang tidak diketahui (analit). Dua metode titrimetri yang paling umum digunakan adalah titrasi asam-basa dan titrasi redoks. Itu perbedaan utama Antara titrasi asam-basa dan titrasi redoks adalah sifat reaksi yang terjadi antara titrant dan analit dalam titrasi. Dalam titrasi asam-basa, reaksi netralisasi terjadi dan dalam titrasi redoks, reaksi redoks terjadi (reaksi pengoksidasi dan reaksi reduksi). Penggunaan indikator adalah metode yang paling umum digunakan untuk menentukan titik akhir reaksi.
Apa itu titrasi asam-basa?
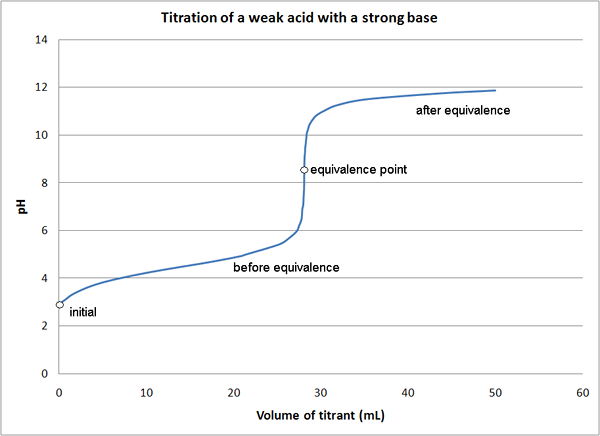
Dalam titrasi asam-basa, asam (titrasi asam) atau basa (titrasi basa) digunakan sebagai titran. Contoh asam yang digunakan dalam titrasi asam adalah H2JADI4, Hcl, atau hno3. Sebagian besar titran dasar yang digunakan adalah naoh, k2BERSAMA3 atau na2BERSAMA3. Titrasi asam-basa dapat diklasifikasikan sebagai berikut tergantung pada kekuatan asam dan basa.
- Asam Kuat - Titrasi Basa Kuat
- Titrasi basa asam yang kuat
- Asam lemah - titrasi basa yang kuat
- Asam lemah - titrasi basa lemah
Pada sebagian besar titrasi asam-basa, indikator digunakan untuk menentukan titik akhir reaksi. Indikator yang berbeda digunakan tergantung pada jenis titrasi seperti yang disebutkan di atas.

Apa itu titrasi redoks?
Titrasi redoks melibatkan reaksi redoks. Reaksi redoks memiliki dua reaksi; reaksi oksidasi dan reaksi reduksi. Proses oksidasi dan reduksi berlangsung pada saat yang sama di mana memungkinkan kami untuk menentukan penyelesaian reaksi. Ini juga dikenal sebagai titik akhir titrasi. Ini dapat ditentukan dalam beberapa cara; Menggunakan elektroda indikator, indikator redoks (indikator menghasilkan warna yang berbeda pada keadaan reduksi oksidasi), dan indikator non-redoks (indikator menghasilkan warna ketika jumlah titran yang berlebih ditambahkan).

Apa perbedaan antara titrasi asam-basa dan titrasi redoks?
Sifat reaksi:
Titrasi asam-basa: Titrasi asam-basa melibatkan reaksi netralisasi antara analit (larutan dengan konsentrasi yang tidak diketahui) dan titran asam atau basa.
Titrasi redoks: Reaksi redoks melibatkan reaksi oksidasi dan reduksi antara analit dan titran. Tidak ada aturan yang mengoksidasi komponen dan yang dikurangi. Baik analit atau titrant teroksidasi, dan komponen yang tersisa berkurang sesuai.
Penentuan titik akhir:
Titrasi asam-basa: Secara umum, indikator pH, meter pH atau meter konduktansi digunakan untuk menentukan titik akhir dari titrasi asam-basa.
Titrasi redoks: Metode yang paling umum digunakan untuk menentukan titik akhir reaksi redoks menggunakan potensiometer atau indikator redoks. Tapi, paling sering analit atau titrant menghasilkan warna di titik akhir. Sehingga, indikator tambahan tidak diperlukan dalam kasus tersebut.
Contoh:
Titrasi asam-basa:
| Jenis | Reaksi (indikator) |
| Asam Kuat - Titrasi Basa Kuat | Hcl + naohànacl + h2O (Phenolphthalein /Methyl Orange) |
| Asam kuat - titrasi basa lemah | Hcl + nh3à nh3Cl (metil oranye) |
| Asam lemah - titrasi basa yang kuat | Ch3Cooh + naohà ch3Coona + h2O (phenolphthalein) |
| Titrasi Basa Asam Lemah | Ch3COOH + NH3àch3MENDEKUT-+NH4+(Tidak ada indikator yang cocok) |
Titrasi redoks:
2 kmno4 + 5 jam2C2HAI4 + 6 hcl → 2 mncl2 + 2KCL + 10 CO2 + 8 h2HAI
(+7) (+3) (+2) (+4)
Dalam reaksi di atas, permanganat berkurang saat asam oksalat teroksidasi. Saat reaksi selesai, warna ungu permanganat berubah menjadi tidak berwarna.
Kmno4 + 5fecl2 +8hcl → 5fecl3+Mncl2+Kcl+4h2HAI
(+7) (+2) (+3) (+2)
Gambar milik:
1. Titrasi asam lemah dengan basa kuat oleh kuantumkinetik (karya sendiri) [CC oleh 3.0], via Wikimedia Commons
2. “Winkler Titration Prior Titration” oleh Willwood [CC BY-SA 3.0] Via Commons


