Perbedaan antara kekosongan tetrahedral dan oktahedral
Perbedaan Utama - Kosong Tetrahedral vs Octahedral
Saat mempertimbangkan zat anorganik yang dikemas erat, ada ruang kosong yang dikenal sebagai rongga. Kosong adalah ruang kosong yang kosong dari sel unit dalam zat anorganik. Sel satuan adalah unit mendasar yang menunjukkan pengaturan kimia dari seluruh zat yang terdiri dari unit berulang. Atom, molekul atau ion yang terdiri dari sistem kristal umumnya dikenal sebagai bola. Dalam zat padat yang dikemas erat, ada dua jenis rongga yang dapat diamati; Kosong tetrahedral dan rongga oktahedral. Itu perbedaan utama Antara tetrahedral dan void oktahedral adalah itu Void tetrahedral terlihat pada zat yang memiliki sistem kristal tetrahedral sedangkan rongga oktahedral terlihat pada zat yang memiliki sistem kristal oktahedral.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu kekosongan tetrahedral
3. Apa itu celah oktahedral
4. Kesamaan antara tetrahedral dan voids octahedral
5. Perbandingan Berdampingan - Kosong Tetrahedral vs Octahedral Dalam Bentuk Tabel
6. Ringkasan
Apa itu kekosongan tetrahedral?
Void tetrahedral tidak dihuni, ruang kosong yang ada pada zat yang memiliki sistem kristal tetrahedral. Oleh karena itu, kekosongan ini terjadi di antara empat konstituen. Kekosongan tetrahedral terbentuk ketika satu atom (atau bola) ditempatkan di bawah depresi yang dibentuk oleh tiga atom lainnya (atau bola). Oleh karena itu, dua lapisan atom terlibat dalam pembentukan kekosongan tetrahedral.
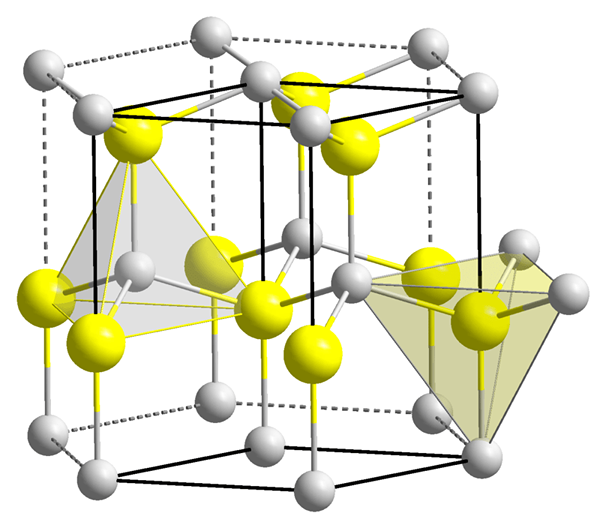
Gambar 1: Dua rongga tetrahedral.
Namun, bentuk kekosongan tetrahedral bukan tetrahedral, hanya susunan empat partikel di sekitar kekosongan adalah tetrahedral. Bentuk rongga sangat rumit. Volume kekosongan tetrahedral jauh lebih kecil dari pada atom (atau bola) yang menyebabkan pembentukan kekosongan. Lebih besar ukuran partikel di sekitar kekosongan, lebih besar ukuran kekosongan. Jumlah koordinasi kekosongan tetrahedral adalah empat. Di sini, istilah nomor koordinasi adalah singkatan dari jumlah atom atau ion segera mengelilingi kekosongan. Dalam sistem kristal, ada dua rongga per bola (atom). Kosong -bakar ini dan ukurannya memiliki pengaruh besar pada sifat material.
Apa itu celah oktahedral?
Void oktahedral tidak dihuni, ruang kosong yang ada pada zat yang memiliki sistem kristal oktahedral. Kekosongan oktahedral terbentuk di antara enam atom (atau bola). Di sana, tiga atom yang dikemas erat (atau bola) membentuk segitiga sama sisi dan ditempatkan di atas tiga atom lainnya yang menyebabkan kekosongan terbentuk. Di sini, juga dua lapisan atom terlibat dalam pembentukan kekosongan.
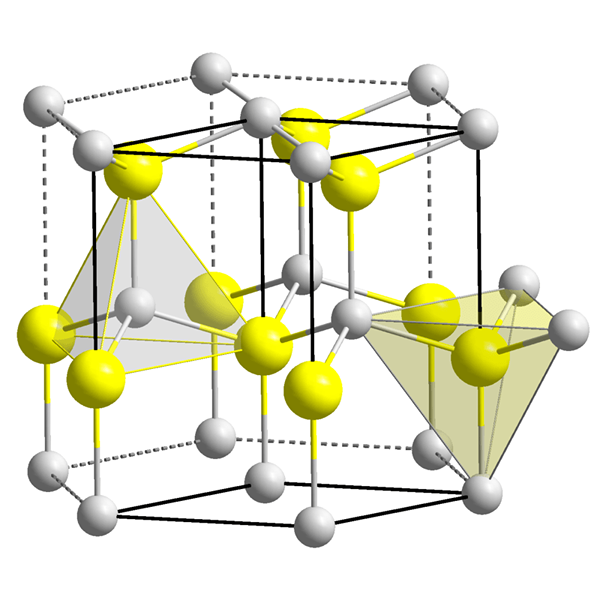
Gambar 2: Kekosongan oktahedral di tengah sel satuan.
Volume kekosongan oktahedral sangat kecil jika dibandingkan dengan kekosongan tetrahedral. Ketika sel unit suatu zat (memiliki pengaturan oktahedral) dipertimbangkan, ada satu kekosongan oktahedral di tengah sel satuan, dan jumlah koordinasi kekosongan ini adalah enam karena enam atom mengelilinginya. Dalam kisi kristal, ada satu kekosongan per satu bola (atau atom).
Apa kesamaan antara void tetrahedral dan oktahedral?
- Keduanya ada di dalam kisi kristal.
- Keduanya lebih kecil dari bola yang membangun kisi kristal.
Apa perbedaan antara tetrahedral dan voids oktahedral?
Kekosongan tetrahedral vs void octahedral | |
| Void tetrahedral tidak dihuni, ruang kosong yang ada pada zat yang memiliki sistem kristal tetrahedral. | Void oktahedral tidak dihuni, ruang kosong yang ada pada zat yang memiliki sistem kristal oktahedral. |
| Sistem kristal | |
| Void tetrahedral dapat ditemukan pada zat yang memiliki pengaturan tetrahedral dalam sistem kristal mereka. | Void Octahedral dapat ditemukan pada zat yang memiliki pengaturan oktahedral dalam sistem kristal mereka. |
| Lokasi di sel satuan | |
| Void tetrahedral dapat diamati di tepi sel satuan. | Void Octahedral dapat diamati di tengah sel satuan. |
| Nomor Koordinasi | |
| Jumlah koordinasi kekosongan tetrahedral adalah empat. | Jumlah koordinasi kekosongan oktahedral adalah enam. |
| Jumlah rongga di kisi kristal | |
| Ada dua rongga tetrahedral per bola di kisi kristal. | Ada satu kekosongan oktahedral per bola di kisi kristal. |
Ringkasan - Kosong tetrahedral vs oktahedral
Kosong adalah ruang kosong yang ada dalam sistem kristal yang muncul karena pengaturan atom yang berbeda. Ada dua jenis void utama yang disebut sebagai kekosongan tetrahedral dan void oktahedral. Perbedaan antara rongga tetrahedral dan oktahedral adalah bahwa void tetrahedral terlihat pada zat yang memiliki sistem kristal tetrahedral sedangkan void oktahedral terlihat pada zat yang memiliki sistem kristal oktahedral oktahedral.
Unduh voids tetrahedral vs oktahedral pdf
Anda dapat mengunduh versi PDF artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi pdf di sini perbedaan antara tetrahedral dan voids octahedral
Referensi:
1.Maramandansubu Ikuti. “Kosong di kristal.”LinkedIn Slideshare, 16 Juni 2013. Tersedia disini
2.“Hakim tetrahedral dan void octahedral.”StudieLayer.com, 12 Mar. 2016. Tersedia disini
Gambar milik;
1.'Wurtzite Polyhedra'by Solid State - karya sendiri, (domain publik) via Commons Wikimedia
2.'Octahedral Crystal Field'by P.Wormer - pekerjaan sendiri, (cc by -sa 3.0) Via Commons Wikimedia


