Perbedaan antara elektrolit yang benar dan potensial
Itu perbedaan utama Antara elektrolit yang benar dan potensial adalah itu elektrolit sejati terdisosiasi menjadi ion sepenuhnya sedangkan elektrolit potensial terdisosiasi menjadi ion sebagian.
Kami dapat mengkategorikan semua senyawa menjadi dua kelompok sebagai elektrolit dan nonelektrolit, tergantung pada kemampuannya untuk menghasilkan ion dan melaksanakan listrik. Elektrolisis adalah proses melewati arus melalui larutan elektrolitik dan memaksa ion positif dan negatif untuk bergerak ke arah elektroda masing -masing. Nonelektrolit tidak dapat mengambil bagian dalam proses elektrolisis.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektrolit sejati
3. Apa itu elektrolit potensial
4. Perbandingan berdampingan - elektrolit potensial vs potensial dalam bentuk tabel
5. Ringkasan
Apa itu elektrolit sejati?
Elektrolit sejati adalah zat yang dapat sepenuhnya terpisah menjadi ionnya. Ini juga dinamai sebagai elektrolit yang kuat. Senyawa -senyawa ini dengan mudah menghasilkan bentuk ionik ketika dilarutkan dalam air atau larutan lain. Ada kation dan anion dalam larutan setelah senyawa dipisahkan; Dengan demikian, ion -ion ini dapat membawa arus listrik melalui larutan elektrolitik. Inilah alasan namanya "elektrolit", yang berarti "kemampuan untuk menghantarkan listrik".
Larutan terkonsentrasi dari elektrolit sejati memiliki tekanan uap rendah daripada air murni pada suhu yang sama. Asam kuat, basa kuat, garam ionik larut yang bukan asam lemah dan basa dapat diklasifikasikan sebagai elektrolit sejati.

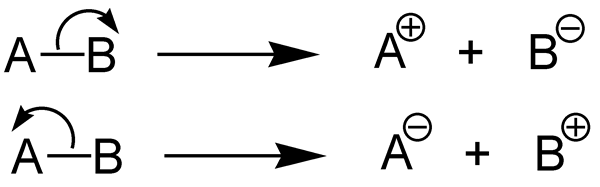
Gambar 01: Disosiasi Lengkap
Saat menulis reaksi kimia untuk ionisasi elektrolit sejati, kita dapat menggunakan panah tunggal dalam satu arah untuk menunjukkan reaksi ionisasi lengkap berbeda dengan potensi atau elektrolit lemah. Panah tunggal ini berarti bahwa reaksi terjadi sepenuhnya. Elektrolit sejati dapat menghantarkan listrik hanya saat dalam keadaan cair atau solusi. Karena ionisasi tinggi, tegangan yang dapat dihasilkan oleh elektrolit sejati sangat tinggi.
Apa itu elektrolit potensial?
Potensi elektrolit adalah zat yang sebagian dapat memisahkan ke dalam ionnya. Ini berarti ia tidak dapat sepenuhnya memisahkan ke dalam ionnya dalam larutan berair. Oleh karena itu, larutan berair dari elektrolit potensial akan mengandung kedua spesies ionik dan molekul yang tidak disimpan. Biasanya, disosiasi elektrolit potensial adalah sekitar 1-10%. Ini juga dinamai elektrolit lemah. Beberapa contoh umum elektrolit lemah termasuk asam asetat, asam karbonat, amonia, asam fosfat, dll. Ini adalah asam lemah atau basa lemah.
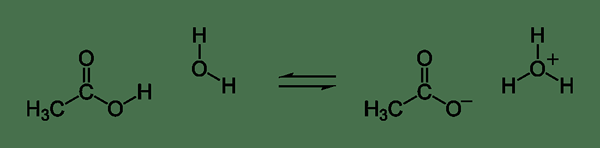
Gambar 02: Reaksi kimia untuk disosiasi asam asetat
Saat menulis reaksi kimia untuk disosiasi elektrolit yang lemah, kami menggunakan dua panah setengah yang mengarahkan ke arah yang berlawanan. Panah ini berarti ada keseimbangan antara spesies ionik dan molekul berserikat dalam larutan berair.
Apa perbedaan antara elektrolit yang benar dan potensial?
Bergantung pada kemampuan mereka untuk menghasilkan ion dan menghantarkan listrik, kami dapat mengkategorikan semua senyawa menjadi dua kelompok sebagai elektrolit dan non -elektrolit. Elektrolit lagi dibagi menjadi dua bagian sebagai elektrolit yang benar dan potensial. Perbedaan utama antara elektrolit true dan potensial adalah bahwa elektrolit sejati terdisosiasi menjadi ion sepenuhnya sedangkan potensial elektrolit terdisosiasi menjadi ion secara parsial. Selain itu, kekuatan disosiasi elektrolit sejati adalah 100% sedangkan kekuatan disosiasi dari elektrolit potensial bervariasi dari 1 hingga 10%.
Tabel berikut merangkum perbedaan antara elektrolit yang benar dan potensial.
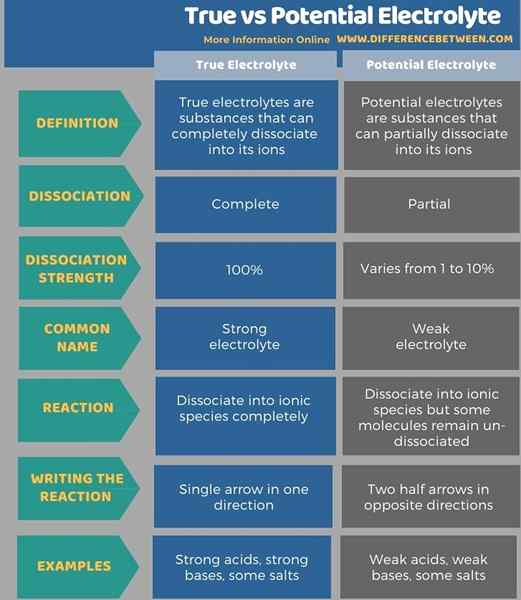
Ringkasan -Elektrolit Potensial True Vs
Elektrolit sejati adalah zat yang dapat sepenuhnya terpisah menjadi ionnya sementara elektrolit potensial adalah zat yang sebagian dapat memisahkan ke dalam ionnya. Oleh karena itu, perbedaan utama antara elektrolit true dan potensial adalah bahwa elektrolit sejati terdisosiasi menjadi ion sepenuhnya, sedangkan elektrolit potensial terdisosiasi menjadi ion sebagian.
Referensi:
1. Helmenstine, Todd. “Definisi dan contoh elektrolit yang lemah."Thoughtco, Feb. 11, 2020, tersedia di sini.
Gambar milik:
1. “Heterolisis (Kimia)” oleh Jürgen Martens (CC BY-SA 3.0) Via Commons Wikimedia
2. “Asetic-Acid-Dissociation-2D” oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia