Perbedaan antara reaksi unimolekul dan bimolekul
Perbedaan utama - unimolekul vs reaksi bimolekul
Dalam kimia, istilah molekulitas digunakan untuk mengekspresikan jumlah molekul yang bersatu untuk bereaksi dalam reaksi dasar. Reaksi dasar adalah reaksi langkah tunggal yang memberikan produk akhir secara langsung setelah reaksi antara reaktan. Ini berarti bahwa reaksi dasar adalah reaksi kimia yang tidak memiliki langkah perantara sebelum pembentukan produk akhir. Reaksi unimolekul dan bimolekul adalah reaksi dasar seperti itu. Itu perbedaan utama Antara reaksi unimolekul dan bimolekul adalah itu Reaksi unimolekul hanya melibatkan satu molekul sebagai reaktan sedangkan reaksi bimolekul melibatkan dua molekul sebagai reaktan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa reaksi unimolekul
3. Apa reaksi bimolekul
4. Kesamaan antara reaksi unimolekul dan bimolekul
5. Perbandingan berdampingan - reaksi bimolekul unimolekul vs dalam bentuk tabel
6. Ringkasan
Apa reaksi unimolekul?
Reaksi unimolekul adalah reaksi dasar yang hanya melibatkan satu molekul sebagai reaktan. Di sana, reaksinya adalah reaksi penataan ulang. Molekul tunggal mengatur ulang untuk membentuk molekul yang lebih berbeda sebagai produk akhir. Tapi ini terjadi dalam satu langkah. Tidak ada langkah perantara yang dialami molekul reaktan dalam pembentukan produk akhir. Itu secara langsung memberikan produk akhir. Persamaan untuk reaksi dapat diberikan sebagai
A → p
Di sini A reaktan dan p adalah produknya. Menurut Ordo Pertama Hukum Tingkat, laju reaksi dapat diberikan seperti di bawah ini.
Rate = k [reaktan]
Beberapa contoh reaksi unimolekul termasuk pengikut:
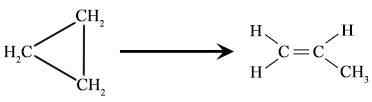
Gambar 01: Penataan ulang Cyclopropane untuk membentuk propana.
- Konversi n2HAI4 menjadi dua tidak2 molekul
- Konversi siklopropan menjadi propene
- Konversi PCL5 ke PCL3 dan Cl2
Apa reaksi bimolekul?
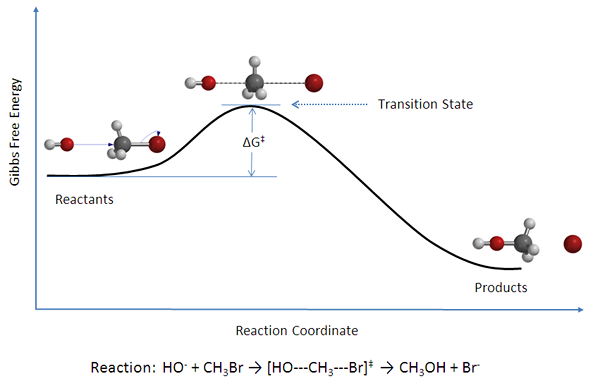
Reaksi bimolekul adalah reaksi kimia dasar yang melibatkan dua molekul sebagai reaktan. Itu dapat digambarkan sebagai tabrakan dari dua molekul atau partikel. Ini adalah reaksi kimia umum dalam kimia organik dan anorganik. Kedua molekul tersebut dapat memiliki jenis yang sama atau berbeda. Sebagai contoh, kedua molekul dapat berupa dua molekul NOCL dengan susunan atom yang sama atau dapat C dan O2 memiliki kombinasi atom yang berbeda. Persamaan untuk reaksi bimolekul diberikan seperti di bawah ini.
A +a → p
A +b → p

Gambar 02: Diagram energi untuk reaksi bimolekul.
Karena ada dua reaktan, reaksi ini dijelaskan sebagai reaksi orde kedua. Oleh karena itu, reaksi bimolekul ini dijelaskan oleh undang -undang tingkat pesanan kedua;
Tingkat = [a]2
Atau
Rate = [a] [b]
Di mana urutan keseluruhan selalu 2. Beberapa contoh reaksi bimolekul diberikan di bawah ini.
- Reaksi antara CO dan tidak3
- Reaksi antara dua molekul NOCL
- Reaksi antara Cl dan ch4
Apa kesamaan antara reaksi unimolekul dan bimolekul?
- Baik reaksi unimolekul dan bimolekul adalah reaksi dasar.
- Baik reaksi unimolekul dan bimolekul memberikan produk dalam satu langkah.
- Baik reaksi unimolekul dan bimolekul tidak memiliki langkah perantara.
Apa perbedaan antara reaksi unimolekul dan bimolekul?
Reaksi unimolekul vs biomolekul | |
| Reaksi unimolekul adalah reaksi dasar yang hanya melibatkan satu molekul sebagai reaktan. | Reaksi bimolekul adalah reaksi kimia dasar yang melibatkan dua molekul sebagai reaktan. |
| Reaktan | |
| Reaksi unimolekul memiliki satu reaktan | Reaksi bimolekul memiliki dua reaktan. |
| Urutan Hukum Tingkat | |
| Reaksi unimolekul dijelaskan melalui undang -undang tarif urutan pertama. | Reaksi bimolekul dijelaskan melalui undang-undang tarif orde kedua. |
| Pesanan keseluruhan | |
| Urutan keseluruhan persamaan laju reaksi unimolekul selalu 1. | Urutan keseluruhan persamaan laju reaksi bimolekul selalu 2. |
Ringkasan -unimolekul vs reaksi bimolekul
Reaksi unimolekul dan bimolekul adalah reaksi dasar. Reaksi ini memberikan produk dalam satu langkah. Reaksi ini dapat dinyatakan menggunakan hukum tarif juga. Perbedaan antara reaksi unimolekul dan bimolekul adalah bahwa reaksi unimolekul hanya melibatkan satu reaktan sedangkan reaksi bimolekul melibatkan dua molekul sebagai reaktan.
Unduh PDF reaksi bimolekul unimolekul
Anda dapat mengunduh versi PDF dari artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi PDF di sini: Perbedaan antara reaksi unimolekul dan bimolekul
Referensi:
1.“Reaksi Dasar.”Kimia Libretexts, Libretexts, 26 Mei 2017. Tersedia disini
2.“Reaksi Dasar.”Wikipedia, Wikimedia Foundation, 10 Feb. 2018. Tersedia disini
3.“Molekuleritas.”Wikipedia, Wikimedia Foundation, 13 Feb. 2018. Tersedia disini
Gambar milik:
1.'Izomerisasi Cyclopropan'by Djokili92 - Karya Sendiri, (CC BY -SA 4.0) Via Commons Wikimedia
2.Diagram koordinat rxn 5'by chem540grp1f08 - pekerjaan sendiri, (cc by -sa 3.0) Via Commons Wikimedia


