Perbedaan antara valensi dan elektron inti
Itu perbedaan utama Antara valensi dan elektron inti adalah itu elektron valensi berpartisipasi dalam formasi ikatan kimia sementara elektron inti tidak.
Atom adalah blok bangunan dari semua zat yang ada. Mereka sangat kecil sehingga kita bahkan tidak bisa mengamatinya dengan mata telanjang kita. Secara umum, atom berada dalam kisaran angstrom. Atom terdiri dari nukleus, yang memiliki proton dan neutron. Ada elektron yang berputar -putar di sekitar nukleus di orbital. Sebagian besar ruang dalam atom kosong. Kekuatan menarik antara nukleus bermuatan positif (muatan positif karena proton) dan elektron bermuatan negatif mempertahankan bentuk atom. Elektron berada di orbital sebagai pasangan dalam atom, dan mereka memiliki putaran yang berlawanan. Selain itu, ada dua jenis elektron sebagai elektron valensi dan elektron inti.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektron valensi
3. Apa itu elektron inti
4. Perbandingan berdampingan - valensi vs elektron inti dalam bentuk tabel
5. Ringkasan
Apa itu elektron valensi?
Elektron valensi adalah elektron dalam atom yang berpartisipasi dalam pembentukan ikatan kimia. Saat ikatan bahan kimia terbentuk, sebuah atom dapat memperoleh elektron, menyumbangkan elektron, atau berbagi elektron. Kemampuan untuk menyumbangkan, mendapatkan, atau berbagi elektron ini tergantung pada jumlah elektron valensi yang mereka miliki. Misalnya, saat h2 Molekul terbentuk, satu atom hidrogen memberikan satu elektron ke ikatan kovalen. Dengan demikian, dua atom berbagi dua elektron. Oleh karena itu, atom hidrogen memiliki satu elektron valensi. Dalam pembentukan natrium klorida, satu atom natrium mengeluarkan satu elektron, sedangkan atom klorin mengambil elektron. Itu terjadi untuk mengisi oktet di orbital valensi mereka. Di sana, natrium hanya memiliki satu elektron valensi, dan klorin memiliki tujuh. Oleh karena itu, dengan melihat elektron valensi, kita dapat menentukan reaktivitas kimia atom.
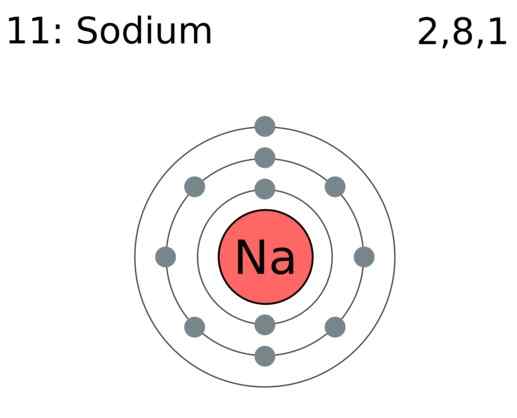
Gambar 01: Atom natrium memiliki satu elektron valensi
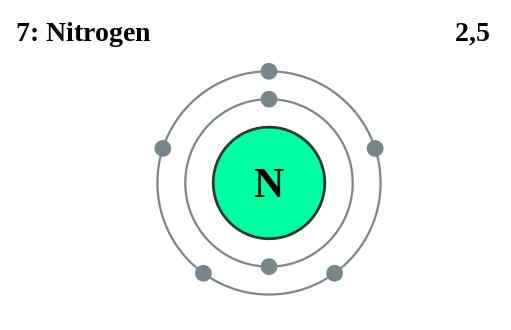
Elemen Grup Utama (Grup I, II, III, dll ...) Memiliki elektron valensi di cangkang terluar. Jumlah elektron valensi setara dengan nomor grup mereka. Atom inert telah menyelesaikan cangkang dengan jumlah maksimum elektron valensi. Untuk logam transisi, beberapa elektron dalam juga bertindak sebagai elektron valensi. Jumlah elektron valensi dapat ditentukan dengan melihat konfigurasi elektron atom. Misalnya, nitrogen memiliki konfigurasi elektron 1s2 2s2 2p3. Elektron di 2nd Shell (yang merupakan angka kuantum utama tertinggi dalam hal ini) diambil sebagai elektron valensi. Oleh karena itu, nitrogen memiliki lima elektron valensi. Selain berpartisipasi dalam ikatan, elektron valensi adalah alasan untuk konduktivitas termal dan listrik elemen.
Apa itu elektron inti?
Elektron inti adalah elektron selain elektron valensi atom. Karena elektron -elektron ini berada di lokasi dalam atom, elektron inti tidak berpartisipasi dalam pembentukan ikatan. Mereka tinggal di cangkang bagian dalam atom. Misalnya, dalam atom nitrogen (1s2 2s2 2p3), lima elektron dari ketujuh adalah elektron valensi, sedangkan dua elektron 1S adalah elektron inti.

Gambar 02: Nitrogen memiliki dua elektron inti
Selain itu, energi yang dibutuhkan untuk menghilangkan elektron inti dari atom sangat tinggi dari energi yang dibutuhkan untuk elektron valensi.
Apa perbedaan antara valensi dan elektron inti?
Baik elektron valensi dan elektron inti bergerak di sekitar inti atom. Elektron valensi berada di cangkang elektron terluar sementara elektron inti berada di cangkang dalam. Misalnya, atom nitrogen memiliki 5 elektron valensi dan 2 elektron inti sesuai dengan konfigurasi elektron; 1s2 2s2 2p3. Auveall, perbedaan utama antara valensi dan elektron inti adalah bahwa elektron valensi berpartisipasi dalam pembentukan ikatan kimia, tetapi elektron inti tidak.
Selain itu, perbedaan signifikan lainnya antara valensi dan elektron inti adalah bahwa energi yang diperlukan untuk menghilangkan elektron inti sangat tinggi jika dibandingkan dengan energi yang diperlukan untuk menghilangkan elektron valensi.
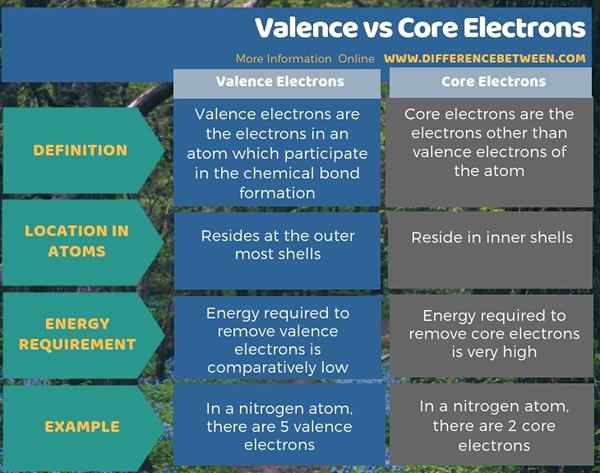
Ringkasan -elektron valensi vs inti
Ada dua jenis elektron dalam atom sebagai elektron valensi dan elektron inti. Elektron valensi berada di kulit terluar sementara elektron inti berada di cangkang dalam. Perbedaan utama antara valensi dan elektron inti adalah bahwa elektron valensi berpartisipasi dalam pembentukan ikatan kimia sementara elektron inti tidak.
Referensi:
1. “1.3: elektron valensi dan valensi terbuka.”Kimia Libretexts, Libretexts, 23 Apr. 2019, tersedia di sini.
2. “1.9b: Valensi dan elektron inti.”Kimia Libretexts, Libretexts, 2 Mei 2019, Tersedia Di Sini.
Gambar milik:
1. "Electron Shell 011 Sodium" oleh Greg Robson - Aplikasi: Inkscape (CC BY -SA 2.0 uk) via commons wikimedia
2. “Electron Shell 007 Nitrogen” Par Pumbaa (karya asli oleh Greg Robson) - File: Electron Shell 007 Nitrogen.PNG, (CC BY-SA 2.0 uk) via commons wikimedia


