Perbedaan antara cangkang valensi dan cangkang kedua dari belakang
Itu perbedaan utama antara valence shell dan shell kedua dari belakang Valence Shell adalah cangkang atom yang mengandung elektron terluar, sedangkan cangkang kedua dari belakang adalah cangkang yang bagian dalam ke cangkang yang mengandung elektron terluar.
Istilah valensi cangkang dan cangkang kedua dari belakang digunakan terutama dalam kimia umum saat menentukan komposisi elektron atom tertentu. Valence shell dan shell kedua dari belakang mengandung satu atau lebih elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu shell valence
3. Apa itu cangkang kedua dari belakang
4. Perbandingan berdampingan - valensi shell vs shell kedua belakang dalam bentuk tabel
5. Ringkasan
Apa itu shell valence?
Cangkang valensi adalah cangkang atom yang mengandung elektron terluar. Elektron dalam cangkang ini disebut elektron valensi. Ini adalah elektron yang memiliki daya tarik paling sedikit terhadap inti atom. Itu karena elektron valensi terletak jauh dari nukleus bila dibandingkan dengan elektron lain dari atom itu.
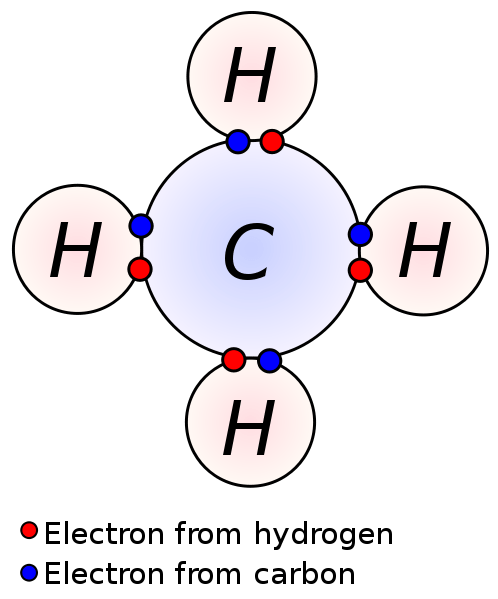
Gambar 01: Elektron valensi yang terlibat dalam pembentukan ikatan
Elektron dalam cangkang valensi bertanggung jawab atas reaksi kimia dan ikatan kimia atom. Karena daya tarik antara elektron -elektron ini dan inti atom lebih sedikit, elektron valensi dapat dengan mudah dihilangkan (daripada elektron dalam orbital dalam). Ini penting dalam pembentukan senyawa ionik dan senyawa kovalen. Dengan kehilangan elektron valensi, atom dapat membentuk kation. Berbagi elektron valensi dari atom dengan elektron valensi dari atom lain menghasilkan ikatan kovalen.
Untuk elemen blok S dan elemen blok P, cangkang valensi masing -masing adalah orbital S dan orbital P. Tetapi untuk elemen transisi, elektron valensi dapat hadir di orbital dalam juga. Ini karena perbedaan energi antara sub-orbital. Misalnya, jumlah atom mangan (MN) adalah 25. Konfigurasi elektron kobalt adalah [ar] 3D54s2. Elektron valensi kobalt harus berada di orbital 4S. Tapi ada 7 elektron valensi di MN. Elektron dalam orbital 3D juga dianggap sebagai elektron valensi karena orbital 3D terletak di luar orbital 4S (energi 3D lebih tinggi dari orbital 4S).
Apa itu cangkang kedua?
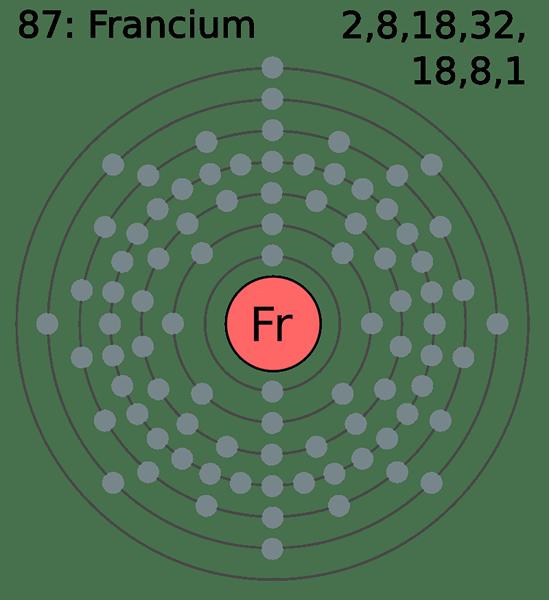
Cangkang kedua dari belakang adalah cangkang yang mengandung elektron yang merupakan bagian dalam ke cangkang valensi terluar. Dengan kata lain, ini adalah cangkang penuh elektron terakhir atau cangkang sebelum cangkang valensi. Oleh karena itu, dibandingkan dengan cangkang valensi, cangkang kedua dari belakang memiliki elektron yang lebih tertarik pada inti atom.

Gambar 02: Atom Francium memiliki delapan elektron di cangkang kedua dari belakang
Selain itu, elektron dalam cangkang kedua dari belakang tidak terlibat dalam ikatan kimia dan proses pembentukan senyawa karena ditutupi dari elektron shell valensi. Namun, dalam logam transisi, elektron dalam cangkang kedua dari belakang dapat menjadi elektron terluar dari atom logam karena perbedaan energi sub-orbital.
Apa perbedaan antara cangkang valensi dan cangkang kedua?
Perbedaan utama antara cangkang valensi dan cangkang kedua adalah cangkang valensi adalah cangkang yang mengandung elektron terluar dari atom. Tapi, cangkang kedua dari belakang adalah satu bagian dalam ke cangkang yang mengandung elektron terluar. Oleh karena itu, cangkang kedua dari belakang lebih dekat ke inti atom daripada cangkang valensi.
Selain itu, elektron dalam cangkang valensi kurang tertarik pada inti atom dibandingkan dengan elektron dalam cangkang kedua dari belakang. Selain itu, elektron dalam cangkang valensi terlibat dalam ikatan kimia dan pembentukan senyawa, sedangkan elektron dalam cangkang kedua dari belakang tidak terlibat dalam reaksi kimia.
Infografis di bawah ini tabulasi perbedaan antara shell valensi dan cangkang kedua.
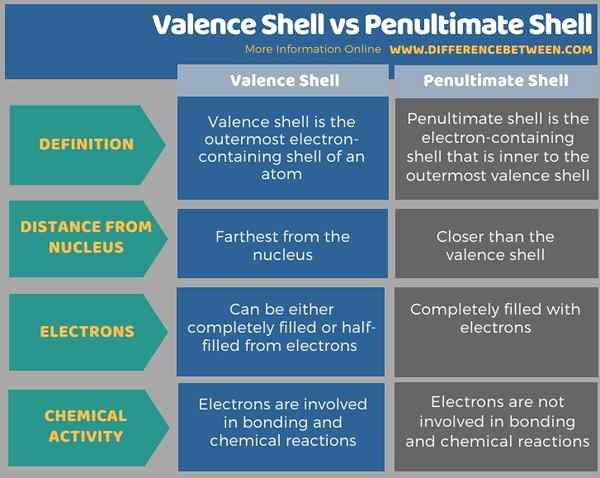
Ringkasan -Valence Shell vs Shell kedua
Valence shell dan shell kedua dari belakang adalah dua istilah kimia yang sangat penting dalam kimia umum. Perbedaan utama antara cangkang valensi dan cangkang kedua dari belakang adalah bahwa cangkang valensi adalah cangkang yang mengandung elektron terluar dari atom sedangkan cangkang kedua dari belakang adalah cangkang yang bagian dalam ke cangkang yang mengandung elektron terluar.
Referensi:
1. Helmenstine, Anne Marie. “Definisi elektron valensi dalam kimia."Thoughtco, Feb. 11, 2020, tersedia di sini.
2. "Elektron valensi.”Wikipedia, Wikimedia Foundation, 6 Feb. 2020, tersedia di sini.
Gambar milik:
1. "Covalent" oleh Dynablast - Dibuat dengan Inkscape (CC BY -SA 2.5) Via Commons Wikimedia
2. “Electron Shell 087 Francium” (CC BY-SA 2.0 uk) via commons wikimedia


