Apa perbedaan antara jumlah atom dan atomisitas
Itu Perbedaan utama antara jumlah atom dan atomisitas adalah bahwa jumlah atom mengacu pada jumlah proton dalam inti atom sedangkan atomisitas mengacu pada jumlah atom yang membentuk molekul tertentu.
Jumlah atom dan atomisitas adalah dua istilah berbeda yang menggambarkan dua fenomena yang berbeda. Jumlah atom adalah jumlah proton yang ada dalam inti atom, sedangkan atomisitas adalah jumlah total atom yang ada dalam molekul.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu nomor atom
3. Apa itu atomisitas
4. Nomor Atom vs Atomisitas dalam Bentuk Tabel
5. Ringkasan -Nomor Atom vs Atomisitas
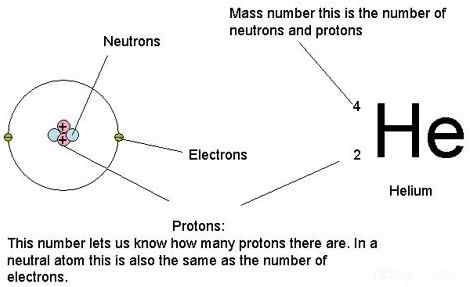
Apa itu nomor atom?
Nomor atom adalah jumlah proton yang ada dalam inti atom. Oleh karena itu, juga dikenal sebagai nomor proton. Nomor atom unik untuk elemen kimia tertentu. Ini membuatnya mudah untuk mengidentifikasi elemen kimia menggunakan nomor proton. Nilai ini identik dengan jumlah muatan nukleus. Selain itu, jika kita mempertimbangkan atom yang tidak bermuatan, jumlah elektron juga mirip dengan nomor atom.

Jumlah massa atom mirip dengan jumlah jumlah proton dan neutron atom. Biasanya, proton dan neutron memiliki massa yang hampir sama. Cacat massa pengikatan nukleon selalu kecil jika dibandingkan dengan massa nukleon. Oleh karena itu, massa atom dari atom apa pun terjadi dalam 1% dari jumlah keseluruhan yang dinyatakan dalam unit massa atom terpadu.
Apa itu atomisitas?
Atomisitas adalah jumlah total atom yang ada dalam molekul. Molekul dapat berupa monoatomik, diatomik, triatomik, atau politisomik. Molekul monoatomik hanya memiliki satu atom sebagai molekul. Ini sebagian besar adalah gas mulia yang menyelesaikan konfigurasi elektron. Molekul diatomik memiliki dua atom per molekul. Demikian pula, molekul triatomik memiliki tiga atom per molekul. Selain itu, molekul polyatomik memiliki lebih dari tiga atom per molekul. Berikut adalah beberapa contoh dari jenis molekul yang berbeda ini.
Monoatomik: Dia, NE, AR, KR, dll.
Diatomik: H2, N2, O2, F2, dan CL2.
Triatomik: O3
Polyatomik: P4, S8
Terkadang, atomisitas digunakan dalam arti yang sama dengan valensi. Kita dapat menggunakan istilah ini untuk merujuk pada jumlah maksimum valensi yang diamati untuk suatu elemen. Biasanya, semua logam dan beberapa elemen lain, termasuk karbon, memiliki struktur yang kompleks, di mana sejumlah besar atom tidak terikat satu sama lain. Oleh karena itu, kami biasanya mengekspresikan atomisitas mereka sebagai 1.
Dalam molekul homonuklear apa pun, atomisitas dapat ditentukan sebagai rasio berat molekul dan berat atom. E.G. Berat molekul molekul oksigen sekitar 31.999. Berat atom dari satu molekul oksigen adalah sekitar 15.999. Dengan membagi 31.999 dari 15.999, kami mendapatkan jawaban 2, yang berarti atomisitas molekul oksigen adalah 2.
Apa perbedaan antara jumlah atom dan atomisitas?
Jumlah atom dan atomisitas adalah dua istilah berbeda yang menggambarkan dua fenomena yang berbeda. Perbedaan utama antara jumlah atom dan atomisitas adalah bahwa jumlah atom mengacu pada jumlah proton dalam nukleus atom, sedangkan atomisitas mengacu pada jumlah atom yang membentuk molekul tertentu.
Di bawah ini adalah ringkasan perbedaan antara angka atom dan atomisitas dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Nomor Atom vs Atomisitas
Jumlah atom dan atomisitas adalah dua istilah berbeda yang menggambarkan dua fenomena yang berbeda. Perbedaan utama antara jumlah atom dan atomisitas adalah bahwa jumlah atom mengacu pada jumlah proton dalam nukleus atom sedangkan atomisitas mengacu pada jumlah atom yang membentuk molekul tertentu.
Referensi:
1. Boudreaux, Kevin A. "Nomor atom." Bagian dari tabel periodik, Texas Tech University System.
Gambar milik:
1. “Penggambaran Nomor Atom” oleh EN: Pengguna: MaterialScientist - Penggambaran Nomor Atom.JPG (CC0) via Commons Wikimedia


